
【题目】人造的115号元素被我国命名为“镆”,取自我国古代宝剑之名“镆铘”。下列相关叙述正确的是
A.镆元素的质量数为115B.镆铘剑中可能含有镆
C.镆原子的中子数为115D.镆铘剑中一定不含镆
科目:高中化学 来源: 题型:
【题目】绿色化学追求减少化工生产对环境造成的污染,下列物质可以称为“绿色氧化剂”的是( )
A.H2O2B.KMnO4C.HNO3D.Ca(ClO)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na2O2与水反应中,叙述正确的是 ( )
A. O2是还原产物 B. NaOH是氧化产物
C. Na2O2是氧化剂,水是还原剂 D. Na2O2既是氧化剂,又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算后填空
(1)质量都为3g的镁和铝,物质的量之比为;将它们分别放入适量的盐酸溶液中恰好完全反应,则消耗的盐酸的物质的量之比为 .
(2)在50mL NaNO3和Na2SO4的混合溶液中,c(Na+)=1mol/L,往其中加入50mL BaCl2溶液恰好完全反应,后得到2.33g白色沉淀,则原混合溶液中c(NO3﹣)=mol/L.
(3)反应 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 可用于实验室制取氯气. 在标准状况下,该反应产生2.24L Cl2时,消耗氧化剂mol,被氧化的物质的质量为g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+![]() O2(g)===H2O(g) ΔH=-242 kJ·mol-1
O2(g)===H2O(g) ΔH=-242 kJ·mol-1
D. 25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前材料科学的发展方兴未艾。B、N、Ti、Fe都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态Fe2+的电子排布式为_____________________________
(2)BF3分子空间结构为___________;在NH3中N原子的杂化方式为_______。
(3)科学家目前合成了N4分子,结合等电子体相关内容判断该分子中N—N键的键角为__________。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图所示。化合物乙的沸点明显高于化合物甲,主要原因是_________________________________________


(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如右上图所示。若该晶体的密度是ρ g·cm-3,则两个最近的Fe原子间的距离为_____________cm。(阿伏加德罗常数用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关,下列有关说法中正确的是
A.氟氯代烷(商品名氟利昂)是常用的制冷剂,它属于烃
B.“西气东输”中的“气”指的是煤气
C.苯的产量可以衡量一个国家的石油化工发展水平
D.用浸泡过高锰酸钾溶液的硅土来吸收水果或者花朵产生的乙烯,以达到保鲜的要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A.纳米Fe3O4分散到适当的分散剂中可得到胶体,能产生丁达尔效应
B.加热条件下金属单质在空气中均可表现出还原性
C.不能导电的化合物均不是电解质
D.电解质溶液导电过程中,离子仅仅发生了定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
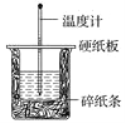
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”)。
(4)该实验常用0.50 mol·L-1HCl和0.55 mol·L-1NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是________,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是______________________________________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),(1分)简述理由: _____________________________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com