【答案】
分析:(1)依据平衡常数概念写出计算表达式,用平衡生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积;平衡常数随温度变化,与压强和浓度变化无关,平衡常数变化结合反应一定原理分析判断;
(2)直接标志:①速率关系:正反应速率与逆反应速率相等,②反应体系中各物质的百分含量保持不变.
间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m+n≠p+q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变;
(3)依据化学反应速率概念结合图表中的数据计算分析,化学反应的速率影响因素分析判断速率大小;
(4)总反应式为:N
2+3H
2?2NH
3.作为发电装置是原电池原理,负极上失电子发生氧化反应,正极上得到电子发生还原反应.
解答:解:(1)在一定体积的密闭容器中,进行如下化学反应:N
2(g)+3H
2(g)?2NH
3(g)△H<0,平衡常数计算表达式为=

;反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,压强增大平衡正向进行但平衡常数不变,故答案为:

;>;不变;
(2)平衡标志最根本的依据是正反应速率等于逆反应速率,反应混合物中各组分的含量保持不变;
A、速率之比等于系数之比,2VH
2(正)=3VNH
3(逆),说明氨气的正反应速率等于氨气的逆反应速率,反应达到平衡,故A符合;
B、N
2的消耗速率等于H
2的消耗速率,只能说明反应正向进行,不能说明反应达到平衡,故B不符合;
C. 溶器内压强保持不变,反应前后气体体积减小,压强不变,说明平衡不变,故C符合;
D.反应体系中 物质质量守恒,体积相同,密度不变,反应进行过程中,平衡状态混合气体的密度保持不变,故D不符合;
E.气体平均摩尔质量=
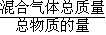
,反应中质量不变,反应前后气体物质的量减小,容器中气体的平均相对分子质量不随时间而变化,证明反应达到平衡,故E符合;
F.混合气体的颜色保持不变,混合气体是无色混合气体,故F不符合;
故答案为:A、C、E;
(3)实验1中以v(NH
3)表示的反应速率=

=
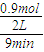
=0.05mol/L?min;影响化学反应的因素中 温度变化是影响最大的,镁升高10°C,反应速率增大到原来的2-4倍实验2是900°C进行的反应,实验2的速率比实验1快,故答案为:实验2温度高于实验1;
(4)合成氨的反应为,N
2+3H
2?2NH
3.原电池中负极是物质失电子发生氧化反应,正极是物质得到电子发生还原反应,所以正极上发生反应的物质是N
2,得到电子与氢离子结合生成氨气;电极反应式为:N
2+6e
-+6H
+=2NH
3,故答案为:N
2+6e
-+6H
+=2NH
3 .
点评:本题考查了平衡常数的计算应用,影响因素的分析判断,平衡标志的判断,反应速率的计算,原电池电极反应的书写方法,题目难度中等.


 ;反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,压强增大平衡正向进行但平衡常数不变,故答案为:
;反应是放热反应,依据图表数据分析,温度升高,平衡逆向进行,平衡常数减小,压强增大平衡正向进行但平衡常数不变,故答案为: ;>;不变;
;>;不变;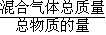 ,反应中质量不变,反应前后气体物质的量减小,容器中气体的平均相对分子质量不随时间而变化,证明反应达到平衡,故E符合;
,反应中质量不变,反应前后气体物质的量减小,容器中气体的平均相对分子质量不随时间而变化,证明反应达到平衡,故E符合; =
=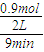 =0.05mol/L?min;影响化学反应的因素中 温度变化是影响最大的,镁升高10°C,反应速率增大到原来的2-4倍实验2是900°C进行的反应,实验2的速率比实验1快,故答案为:实验2温度高于实验1;
=0.05mol/L?min;影响化学反应的因素中 温度变化是影响最大的,镁升高10°C,反应速率增大到原来的2-4倍实验2是900°C进行的反应,实验2的速率比实验1快,故答案为:实验2温度高于实验1;

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g).其化学平衡常数K和温度T的关系如下表,回答下列问题: