
【题目】石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有![]() 结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由![]() 聚合成的,其化学方程式是____________。
聚合成的,其化学方程式是____________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.实验室要配制240mL 0.2mol·L-1的Na2CO3溶液,试回答下列各题:
(1)若用Na2CO3固体配制溶液,下列仪器中,不需要用到的是______________。
A.锥形瓶 B.200mL容量瓶 C.烧杯 D.胶头滴管
E.药匙 F.托盘天平 G.洗瓶 H.试剂瓶
(2)若要实施配制,除上述仪器外,尚缺的必须的仪器是________________________。
(3)需要称量Na2CO3固体的质量是____________________________ 。
(4)下列四项操作会导致所得溶液浓度偏高的是__________。
a.容量瓶不干燥
b.定容时俯视容量瓶刻度线
c.称量Na2CO3固体时物体和砝码放反了(1克以下用游码)
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
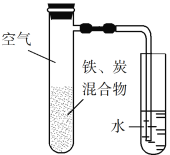
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究不同 pH 时 CuSO4 溶液对 H2O2 分解的催化作用。资料:a.Cu2O 为红色固体,难溶于水,能溶于硫酸,生成 Cu 和Cu2+。b.CuO2 为棕褐色固体,难溶于水,能溶于硫酸,生成 Cu2+和 H2O2。c.H2O2 有弱酸性:H2O2 ![]() H+ +HO2-,HO2-
H+ +HO2-,HO2- ![]() H+ +O22-。
H+ +O22-。
编号 | 实验 | 现象 |
Ⅰ | 向 1 mL pH=2 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 出现少量气泡 |
Ⅱ | 向 1 mL pH=3 的 1 mol·L 1 CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生少量棕黄色沉淀,出现较明显气泡 |
Ⅲ | 向 1 mL pH=5 的 1 mol·L 1CuSO4溶液中加入 0.5 mL 30% H2O2 溶液 | 立即产生大量棕褐色沉淀,产生大量气泡 |
(1) 经检验生成的气体均为 O2,Ⅰ中 CuSO4 催化分解 H2O2 的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出 2 种假设:ⅰ.CuO2,ⅱ.Cu2O 和CuO2 的混合物。为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为 CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在 Cu2O,设计如下实验:
将Ⅲ中沉淀洗涤、干燥后,取 a g 固体溶于过量稀硫酸,充分加热。冷却后调节溶液 pH,以 PAN 为指示剂,向溶液中滴加 c mol·L 1EDTA 溶液至滴定终点,消耗 EDTA 溶液 V mL。V=__,可知沉淀中不含 Cu2O,假设ⅰ成立。(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96 g·mol 1,M(Cu2O)=144 g·mol1)
(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__ 。
(4)研究Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 分解速率不同的原因。
实验Ⅴ:在试管中分别取 1 mL pH=2、3、5 的 1 mol·L1 Na2SO4 溶液,向其中各加入 0.5 mL 30% H2O2 溶液,三支试管中均无明显现象。
实验Ⅵ:__(填实验操作和现象),说明 CuO2 能够催化 H2O2 分解。
(5)综合上述实验,Ⅰ、Ⅱ、Ⅲ中不同 pH 时 H2O2 的分解速率不同的原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g);△H = —483.6kJ·mol-1,则氢气的燃烧热为241.8kJ
B.已知4P(红磷,s)=P4(白磷,s); △H >0,则白磷比红磷稳定
C.含2.0g NaOH的稀溶液与稀硫酸完全中和,放出2.87kJ的热量,则表示该反应中和热的热化学方程式为: NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(1); △H = —57.4kJ·mol-1
D.已知C(s)+O2(g)=CO2(g); △H1 C(s)+1/2O2(g)=CO(g); △H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海藻中含有丰富的碘元素(以I形式存在)。实验室中提取碘的流程如下:

(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78 ℃) B.四氯化碳(沸点77 ℃)
C.甘油(沸点290 ℃) D.苯(沸点80 ℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量________(填序号)溶液,反应的离子方程式___________________。
A.KIO3 B.HClO C.KI D.Br2
(4)利用碘的有机溶液得到单质I2的方法是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组同学探究在实验室中![]() 检验的干扰因素。
检验的干扰因素。
(1)检验溶液中是否含有![]() 时先用过量盐酸将溶液酸化,其目的是排除_______________、
时先用过量盐酸将溶液酸化,其目的是排除_______________、![]() 、Ag+等离子可能造成的干扰。
、Ag+等离子可能造成的干扰。
(2)为了验证盐酸能否排除![]() 的干扰,该小组同学进行了如下实验:
的干扰,该小组同学进行了如下实验:
Ⅰ.量取一定体积的浓盐酸(盛放浓盐酸试剂瓶的标签中部分信息如下图),稀释,配制成 5 mol/L 的稀盐酸。

Ⅱ.甲同学取 0.3 g 未变质的 Na2SO3 固体,向其中加入上述 5mol/L 稀盐酸至过量,产生大量气泡。充分振荡后滴加 4 滴BaCl2 溶液,迅速产生白色浑浊,产生白色浑浊的原因可能是:
①______________。
②盐酸中含有 Fe3+,实验证实含有 Fe3+的方案是:___________________,用离子方程式解释由 Fe3+产生白色浑浊的原因:__________。
(3)乙同学提出,检验![]() 时能否用硝酸酸化来排除
时能否用硝酸酸化来排除![]() 的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
的干扰,丙同学认为不可行,理由是(用离子方程式表示)____________________________,继续实验:称取 5 份 0.3 g 未变质的Na2SO3 固体,分别向其中加入 10 mL 不同浓度的硝酸, 振荡;再滴加 4 滴BaCl2 溶液,观察并记录实验现象如下表。
硝酸浓度(mol/L) | 滴加氯化钡溶液之前现象 | 滴加氯化钡溶液之后现象 |
15.0(浓硝酸) | 产生大量红棕色气体,溶液呈黄色 | 立即产生大量白色沉淀 |
7.5 | 产生大量红棕色气体,溶液呈淡黄色 | 立即产生大量白色沉淀 |
4.8 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 60 min 后溶液开始变浑浊 |
2.0 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 70 min 后溶液开始变浑浊 |
0.5 | 产生少量无色、刺激性气味气体,溶液无色 | 开始无现象,约 120 min 后溶液开始变浑浊 |
依据上述实验得出的结论是:________________。
(4)丙同学查阅资料后提出:Cl-的存在也会对![]() 的检验产生干扰。在 Cl-催化作用下,稀硝酸可将
的检验产生干扰。在 Cl-催化作用下,稀硝酸可将![]() 氧化为
氧化为 ![]() 。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
。为证明上述观点,设计如下实验,请将实验ⅱ的操作补充完整。
实验 | 实验操作 | 实验现象 |
ⅰ | 将 0.3 g Na2SO3 和 0.3 g NaCl 固体混合,加入 10 mL 2.0mol/L 的稀硝酸,振荡后,再滴加 4 滴 BaCl2 溶液。 | 立即产生大量白色沉淀。 |
ⅱ | ____________。 | 放置两小时后溶液未变浑浊。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2019 年第十届国际二次电池展中,一种以 Fe[Fe(CN)6]为代表的新型可充电钠离子电池,格外引人注意,其放电工作原理如图所示。下列说法正确的是
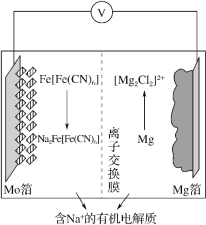
A.充电时,阴极反应式为 Fe[Fe(CN)6 ]+2Na++2e- =Na2Fe[Fe(CN)6 ]
B.充电时,Mg 箔接电源的正极
C.放电时,Na+通过离子交换膜从右室移向左室
D.放电时,外电路中通过 0.4mol 电子时,负极质量变化为 9.2g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com