
【题目】.实验室要配制240mL 0.2mol·L-1的Na2CO3溶液,试回答下列各题:
(1)若用Na2CO3固体配制溶液,下列仪器中,不需要用到的是______________。
A.锥形瓶 B.200mL容量瓶 C.烧杯 D.胶头滴管
E.药匙 F.托盘天平 G.洗瓶 H.试剂瓶
(2)若要实施配制,除上述仪器外,尚缺的必须的仪器是________________________。
(3)需要称量Na2CO3固体的质量是____________________________ 。
(4)下列四项操作会导致所得溶液浓度偏高的是__________。
a.容量瓶不干燥
b.定容时俯视容量瓶刻度线
c.称量Na2CO3固体时物体和砝码放反了(1克以下用游码)
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
【答案】AB 250mL容量瓶、玻璃棒 5.3g b
【解析】
根据配制溶液的步骤分析需要的仪器;配制240mL 0.2mol·L-1的Na2CO3溶液,应选择250mL容量瓶,配制250mL溶液;根据![]() 分析实验误差。
分析实验误差。
(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀、装瓶保存,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管、试剂瓶,配制240mL 0.2mol·L-1的Na2CO3溶液,应选择250mL容量瓶,用不到的仪器是锥形瓶和200mL容量瓶,故选AB;
(2)根据(1)的分析,若要实施配制,除上述仪器外,尚缺的必须的仪器是250mL容量瓶、玻璃棒;
(3)应选择250mL容量瓶,配制250mL溶液,需要称量Na2CO3固体的质量是0.2mol·L-1×0.25L×106g/mol=5.3g;
(4)a.需要加水定容,所以容量瓶不干燥,对实验无影响,故不选a;
b.定容时俯视容量瓶刻度线,所配溶液体积偏小,所得溶液浓度偏高,故选b;
c.称量Na2CO3固体时物体和砝码放反了(1克以下用游码),称取碳酸钠质量偏小,所得溶液浓度偏低,故不选c;
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,所配溶液体积偏大,所得溶液浓度偏低,故不选d;
答案为b。


科目:高中化学 来源: 题型:
【题目】在体积可变的密闭容器中发生可逆反应:2NO2(g)![]() 2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
2NO(g)+O2(g)。能作为反应达到平衡状态的标志是
A.单位时间内生成n mol O2的同时生成n mol NO2
B.NO2、NO、O2三者的物质的量浓度之比为2:2:1
C.混合气体的密度不再改变
D.容器中气体压强不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可测定中和热。下列关于该实验的说法正确的是
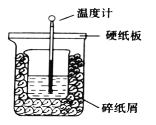
A.从实验装置看(量筒未画出),图中还缺少一个重要的仪器
B.做完一次完整的中和热测定实验,温度计需要使用2次
C.烧杯间的碎纸屑的作用是固定烧杯的位置
D.由于实验过程中有热量的散失,所以测得的中和热△H比理论值要小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸与碳酸钙反应生成CO2,运用下图,可测定该反应的速率.请根据要求填空:
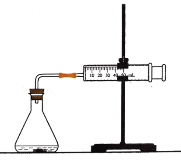
(1)连接好仪器后,需要检查_____________________,再加入药品进行实验.
(2)在锥形瓶中加入5g大理石,加入20mL 1mol·L1盐酸.每隔10s观测玻璃注射器中气体的体积,并以mL·s1为反应速率的单位,计算每10s时间间隔内的反应速率。数据处理的结果见下面的表格:
时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
反应速率/mL·s1 | 0.4 | 1.0 | 1.1 | ? | 0.9 | 0.8 |
表格中的“?”处应填的数据是_________________.
(3)从反应速率随时间变化的数据可知,本实验中反应速率与___________和__________有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是

A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:6H2(g)+2CO2(g)![]() C2H5OH(g)+3H2O(g)的数据如图所示。
C2H5OH(g)+3H2O(g)的数据如图所示。
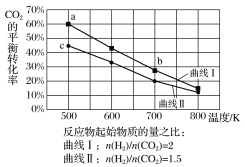
下列说法正确的是( )
A.该反应为吸热反应
B.达平衡时,v正(H2)=v逆(CO2)
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有![]() 结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由![]() 聚合成的,其化学方程式是____________。
聚合成的,其化学方程式是____________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
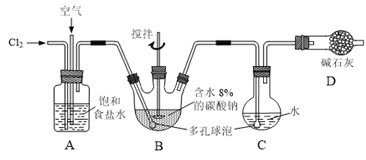
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com