
Cl2合成有机物时会产生副产物HC1。4HCl+O2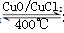 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
完成下列填空:
(1)该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L? min。
(2)若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 。
a.v (HCl)="2" v(Cl2)
b.4v正(HCl)= v逆(O2)
c.又加入1mol O2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
(3)下图是该反应两种投料比[n (HCl):n (O2)分别为4:1和2:1 ] 下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是 。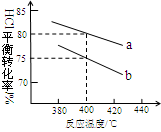
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(4)投料比为4:1、温度为400℃时,平衡混合物中Cl2的物质的量分数是 。
(1)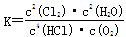 (1分) 0.0625mol/L?min (1分)
(1分) 0.0625mol/L?min (1分)
(2)a c(2分)
(3)a d(2分)
(4)0.3529(0.353、0.35均可)(2分)
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式4HCl+O2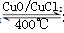 2Cl2+2H2O可知,该反应的平衡常数
2Cl2+2H2O可知,该反应的平衡常数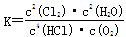 ;8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则:
;8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则:
4HCl+O2 2Cl2+2H2O 物质的量减少△n
2Cl2+2H2O 物质的量减少△n
4mol 1mol
n(HCl) 2.5mol-2.25mol=0.25mol
所以n(HCl)=0.25mol×4=1mol
则c(HCl)=1mol÷2L=0.5mol/L
故v(HCl)=0.5mol/L÷8min=0.0625mol/(L?min)
(2)a.平衡时不同物质表示的速率之比等于化学计量数之比,故v(HCl)=2v(Cl2),因此a正确;b.4v正(HCl)=v逆(O2),即4v正(HCl): v逆(O2)=1:4,不等于化学计量数之比4:1,反应未到达平衡,向逆反应进行,故b错误;c.加入1mol O2,氧气的浓度增大,平衡向正反应方向移动,HCl的转化率增大,故c正确; d.分离出H2O,生成的浓度降低,达新平衡时,v正(HCl)降低,故d错误,答案选ac。
(3)a.由图可知,投料比一定时,温度越高HCl的转化率越低,故该反应正反应是放热反应,因此a正确;b.升高温度平衡向逆反应方向移动,平衡常数k降低,故b错误;c.平衡常数增大应降低温度,平衡向正反应方向移动,改变体积瞬间反应速率降低,此后正反应速率降低、逆反应速率增大,故c错误;d.平衡常数增大应降低温度,该反应正反应是放热反应,平衡向正反应方向移动,故d正确,答案选ad。
(4)增大一种反应物的浓度,平衡向正反应方向移动,其它反应物的转化率增大,故投料比n(HCl):n(O2)=2:1到达平衡时HCl的转化率更高。由图象可知,a曲线表示的HCl的转化率更高,故a表示投料比为2:1,b表示投料比为4:1。由图可知,投料比为4:1、温度为40℃时,HCl的转化率为75%,设n(HCl):=4mol、n(O2)=1mol,则参加反应的HCl为4mol×75%=3mol,则:
4HCl+O2 2Cl2+2H2O
2Cl2+2H2O
起始量(mol) 4 1 0 0
变化量(mol) 3 0.75 1.5 1.5
平衡量(mol) 1 0.25 1.5 1.5
所以平衡混合物中Cl2的物质的量分数是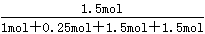 =0.3529。
=0.3529。
考点:考查反应速率、平衡常数的有关计算;外界条件对反应速率和平衡状态的影响


科目:高中化学 来源: 题型:填空题
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)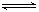 2NH3(g)+CO2(g) △H =" a" kJ/mol
2NH3(g)+CO2(g) △H =" a" kJ/mol
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol·L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g) CH3OH(g)。根据题意完成下列问题:
CH3OH(g)。根据题意完成下列问题: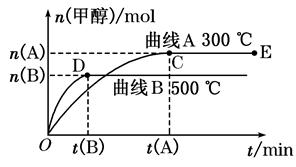
(1)反应达到平衡时,平衡常数表达式K=_________________,升高温度,K值___________(填“增大”、“减小”或“不变”),平衡向 方向移动。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________________。
(3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(选填选项字母)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
D.重新平衡时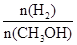 增大 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。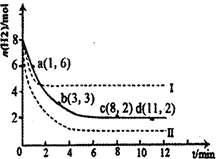
①下列时间段平均反应速率最大的是__________,最小的是______________。
| A.0~1min | B.1~3min | C.3~8min | D.8~11min |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家一直致力于“人工固氮”的新方法研究。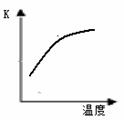
(1)最新“人工固氮”的研究报道:常温常压.光照条件下,N2在催化剂表面与水发生反应:2N2 (g)+6H2O(l) 4NH3 (g)+3O2 (g)+ Q
4NH3 (g)+3O2 (g)+ Q
已知该反应的平衡常数K与温度的关系如右图,则此反应的 Q 0 (填“>”“<”或“=”)。
(2)常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号)。
A.容器中气体的平均分子量不随时间而变化 B.v(N2)/ v(O2)=2:3
C.容器中气体的密度不随时间而变化 D.通入稀有气体能提高反应的速率
(3)将反应生成的混合气体通入水中即可得氨水。用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而增大的是 (填字母标号)。
A.c(H+)×c(NH3·H2O)/c(OH-) B.c(NH4+)×c(OH-)/c(NH3·H2O)
C.c(H+)·c(OH-) D.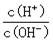
(4)常温下,在恒压密闭容器中上述反应达到平衡后,在其他条件不变时,通入2mol N2,请在右图中画出正(v正).逆(v逆)反应速率随时间t变化的示意图。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g)  W (s) + 3H2O (g) 请回答下列问题:
W (s) + 3H2O (g) 请回答下列问题:
(1)在一定温度下进行上述反应,若反应容器的容积为0.5 L,2min后达到平衡,测得固体的质量减少了4.80 g,则H2的平均反应速率_________;该反应的平衡常数表达式K=___________
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为__________;随温度的升高,H2与水蒸气的体积比减小,则该反应为 ____(填“吸热”或“放热”) 反应。
(3)一定温度下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是________。
A.混合气体的总压强保持不变 B.v正(H20)= v正(H2)
C.混合气体的密度保持不变 D.混合气体的平均式量保持不变
(4)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)  WI4 (g)。下列说法正确的有__________。
WI4 (g)。下列说法正确的有__________。
A.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.灯管内的I2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
科学家一直致力于“人工固氨”的新方法研究。目前合成氨技术原理为:N2(g) +3H2(g)  2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。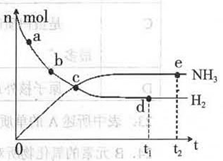
(1)下列叙述正确的是
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点e处的n (N2)相同
D.773K,30MPa 下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
(2)在容积为2.0 L恒容得密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下,N2(g)+3H2(g)  2NH3(g)的平衡常数值为:___。
2NH3(g)的平衡常数值为:___。
(3)K值越大,表明反应达到平衡时( )。
A. H2的转化率一定越高 B.NH3的产量一定越大
C.正反应进行得越完全 D.化学反应速率越大
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温、常压下高转化率的电解合成氨。其实验装置如图。阳极的电极反应为:H2-2e→2H+,则阴极的电极反应为:_____________。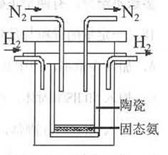
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法。该法的工艺流程为CrO42-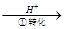 Cr2O72-
Cr2O72-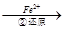 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O
Cr2O72- (橙色)+H2O
(1)若平衡体系的pH=2,该溶液显________色。
(2)能说明第①步反应达平衡状态的是__________。
a.Cr2O72-和CrO42-的浓度相同
b.2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(3)第②步中,还原1 mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为__________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)_________________________________。溶液中同时生成的沉淀还有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图31-1所示: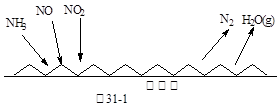
①由图31-1可知SCR技术中的氧化剂为: 。
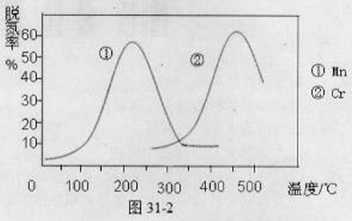
②图31-2是不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知最佳的催化剂和相应的温度分别为: 、 。
③用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图31-3所示,脱氮效果最佳的c(NO2)/c(NO)= 。已知生成1molN2反应放出的热量为QkJ,此时对应的脱氮反应的热化学方程式为 。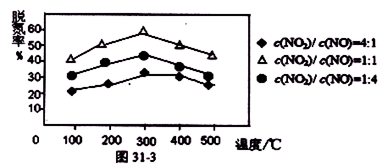
(2)利用喷雾干燥法脱硫工艺是除去SO2的常见方法,先将含SO2的废气溶于水,再用饱和石灰浆吸收,具体步骤如下:
SO2(g)+H2O(l) H2SO3(l)
H2SO3(l) H+(aq)+HSO3—(aq) I
H+(aq)+HSO3—(aq) I
HSO3—(aq) H+(aq)+SO32—(aq) II
H+(aq)+SO32—(aq) II
Ca(OH)2(s) Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+2OH—(aq) III
Ca2+(aq)+SO32—(aq) CaSO3(s) IV
CaSO3(s) IV
④步骤II的平衡常数K的表达式为 。
⑤该温度下,吸收液中c(Ca2+)一直保持为0.70mol/L,已知Ksp(CaSO3)=1.4×10-7,则吸收后溶液中的SO32-的浓度。(写出计算过程,保留2位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com