
��8�֣�һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����CO(g)��2H2(g) CH3OH(g)��������������������⣺
CH3OH(g)��������������������⣺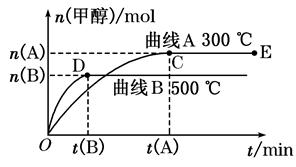
��1����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK��_________________�������¶ȣ�Kֵ___________�����������С�����䡱����ƽ���� �����ƶ���
��2����500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��________________��
��3���������������������£�������E�����ϵ���ѹ����ԭ����1/2�������йظ���ϵ��˵����ȷ����________��ѡ��ѡ����ĸ����
| A��������Ũ�ȼ��� |
| B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ� |
| C���״������ʵ������� |
D������ƽ��ʱ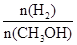 ���� ���� |
��1��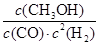 �� ��С �� �淴Ӧ �� ��2��
�� ��С �� �淴Ӧ �� ��2��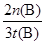 mol/(L��min) ��
mol/(L��min) ��
��3��BC �� ��4��Cu2O��CO 2Cu��CO2
2Cu��CO2
���������������1����ѧƽ�ⳣ������һ�������£������淴Ӧ�ﵽƽ��״̬ʱ��������Ũ�ȵ���֮���ͷ�Ӧ��Ũ�ȵ���֮���ı�ֵ�����Ը��ݷ�Ӧ�Ļ�ѧ����ʽ��֪���÷�Ӧ��ƽ�ⳣ��K��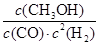 ������ͼ���֪�������¶ȣ��״������ʵ�����С����˵��ƽ�������ƶ�����˻�ѧƽ�ⳣ����С��
������ͼ���֪�������¶ȣ��״������ʵ�����С����˵��ƽ�������ƶ�����˻�ѧƽ�ⳣ����С��
��2����ͼ���֪����500��ʱ��ʱ��ﵽt(B)ʱ���״������ʵ���Ϊn(B)����Ũ����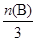 mol/L������ݷ���ʽ��֪���������������ʵ���Ũ����2��
mol/L������ݷ���ʽ��֪���������������ʵ���Ũ����2��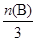 mol/L��������500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��
mol/L��������500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��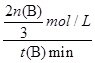 ��
��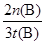 mol?��L?min��-1��
mol?��L?min��-1��
��3��������������ʱ��������E�����ϵ���ѹ����ԭ����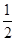 �������������С����ѹǿ�������淴Ӧ���ʶ�����.��������Ӧ�������С�ģ�����ƽ���������ƶ����״������ʵ������࣬���������ʵ�����С�������������С��ƽ��ʱ������Ũ�ȷ������������ȷ��ѡBC��
�������������С����ѹǿ�������淴Ӧ���ʶ�����.��������Ӧ�������С�ģ�����ƽ���������ƶ����״������ʵ������࣬���������ʵ�����С�������������С��ƽ��ʱ������Ũ�ȷ������������ȷ��ѡBC��
��4������CO�ܺ�������ͭ��ӦCu2O+CO 2Cu+CO2�����Լ��������̼ƽ�����淴Ӧ�����ƶ������������Ʒ�Ӧ������Ӧ�����ƶ���ά��Cu2O�������䡣
2Cu+CO2�����Լ��������̼ƽ�����淴Ӧ�����ƶ������������Ʒ�Ӧ������Ӧ�����ƶ���ά��Cu2O�������䡣
���㣺����ƽ�ⳣ�������������ƽ��״̬��Ӱ���Լ���Ӧ���ʵļ����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ���¶���2L�ĺ����������У�����2moL̼��2moLCO2�������·�Ӧ�� C(s)+CO2(g)  2CO(g)����H��0
2CO(g)����H��0
���������CO2�����ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��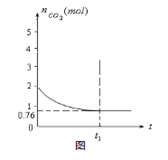
��1���÷�Ӧ�Ħ�S���� 0����������������������������� ����ϸߡ��ϵ͡��� �¶��������ڸ÷�Ӧ�Է����С�
��2����ʽ�����������¶��´˷�Ӧ��ƽ�ⳣ��K�������� �������� �����������һλС����
��3��������ƽ����ϵ����ͨ��CO2����CO2��ת���������� ��������С�����䡢��ȷ������
��4����ͬ�¶��£�2L�ĺ����������м���4moL̼��4moLCO2��4moLCO����ʼ��Ӧʱv(��)�������� v(��)����� ����������
��5����ͬ�¶��£�2L�ĺ����������м���4moL̼��4moLCO2���ﵽƽ�⡣����ͼ�л�����������CO2�����ʵ�����ʱ��t�仯��ϵ��Ԥ�ڽ��ʾ��ͼ����ע��ƽ��ʱCO2�����ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����ͼ����t1ʱ����Ӧ�ķ�Ӧ�����ı����Ϊ��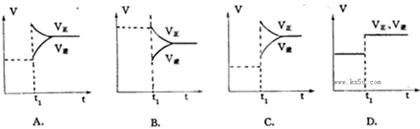
��1�������¶� ����2��ʹ�ô��� ��
��3������Ӧ��Ũ�� ����4������������Ũ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ܱ�����A��B��A��������һ���ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������������Ϊ2:l��SO2��O2�Ļ�����壬��ʹA��B�ݻ����(��ͼ��ʾ)���ڱ���400����¶���ʹ֮�������·�Ӧ��2SO2+O2 2SO3����д���пհף�
2SO3����д���пհף�
(1)SO2��ת���ʦ�(A) ��(B)��(���������������=��)
(2)�ﵽ(1)����ƽ��ʱ��������������ͨ�������������A������ѧƽ�� �ƶ���(�������������)
(3)�ﵽ(1)ƽ����������г��������ԭ��Ӧ���壬�ٴδﵽƽ���B������SO3�ڻ�������е�������� ��(���������С�����䡱)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��16�֣���ҵ�Ͽ����ں����ܱ������в������з�Ӧ�Ʊ��״���
CO��g����2H2��g�� CH3OH��g��
CH3OH��g��
��1���������������Ϊ�жϷ�Ӧ�ﵽƽ��״̬�����ݵ��ǣ�����ţ� ��
A������CH3OH ������������H2������֮��Ϊ1�U2
B����������ƽ����Է����������ֲ���
C�����������ܶȱ��ֲ���
D����ϵ�ڵ�ѹǿ���ֲ���
��2���±���������Ϊ�÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����
| �¶�/�� | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| ���� | �� | �� | �� | |
| Ͷ�Ϸ�ʽ | 1molCO��2molH2 | 1molCH3OH | 2molCH3OH | |
| ƽ������ | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| ��ϵѹǿ(Pa) | p1 | p2 | p3 | |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ԭ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�й����غϳ���(����)ʹ��������Ϊŷ�����ҵ�1/4��Ϊ�˱��������о� Ժ���Ĵ����컯������ʴ���̽����о����ó����и�ʴ������
(1)H2S���Ժϳ����ص���Ȼ������380 K�����Ϊ2 L���ܱ������У��������·�Ӧ��H2(g)��S(s) H2S(g) ��H=��21��6kJ��mol��1����Ӧ�ﵽƽ��ʱH2��S��H2S�����ʵ�����Ϊ3 mol����380 Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______�����жԸ÷�Ӧ������ȷ����______(����ĸ���)��
H2S(g) ��H=��21��6kJ��mol��1����Ӧ�ﵽƽ��ʱH2��S��H2S�����ʵ�����Ϊ3 mol����380 Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______�����жԸ÷�Ӧ������ȷ����______(����ĸ���)��
(2)�ڷ�ӦI�з����Ļ�ѧ��ӦΪ______��
(3)�о����ַ�ӦII�Ƿֱ���Fe��FeSΪ�缫����ˮĤΪ�������Һ�ĵ绯ѧ��ʴ���� ��
��Ϊ______��
��֪��Fe(s)��S(s)=FeS(s) ��H1=��2��5akJ��mol��1
S(s)��O2(g)=SO2(g) ��H2=��5akJ��mol��1
4Fe(s)��3O2(g)=2Fe2O3(s) ��H3=��6akJ��mol��1
��ӦII���Ȼ�ѧ����ʽΪ_____
(4)��֪H2S2O3��K1=2��2��10-1��K2=2��8��10-2��Na2S2O3ˮ��Һ��______�ԣ�����Һ�е���غ�ʽΪ_____ ����ӦIY�ķ�Ӧ����Ϊ______ ���÷�Ӧ______(��ܡ����ܡ��� ˵��FeS�ܽ���ǿ��FeS2O3
(5)���컯���������ո�ʴ����Ϊ______��Ϊ����Ч���������ֽ������컯���������� CuSO4��Һ������(H2S)���������漰�����ӷ���ʽΪ
__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
I���跴Ӧ��Fe(s)+CO2(g) FeO(s)+CO(g)��ƽ�ⳣ��ΪK1����Ӧ ��Fe(s)+H2O(g)
FeO(s)+CO(g)��ƽ�ⳣ��ΪK1����Ӧ ��Fe(s)+H2O(g)  FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
FeO(s)+H2(g)��ƽ�ⳣ��ΪK2���ڲ�ͬ�¶��£�K1��K2��ֵ���£�
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
 CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)��
CO(g)+H2O(g)������һ�� (������š�)�ȷ�Ӧ��Ҫʹƽ��������ƶ����ɲ�ȡ�Ĵ�ʩ�� (�����)�� FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)
FeO(s)+CO(g)���¶�T1�½��У�Fe(s)+H2O(g)  FeO(s)+H2(g)���¶�T2�½��У���֪T1��T2����c(CO2)��c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)��
FeO(s)+H2(g)���¶�T2�½��У���֪T1��T2����c(CO2)��c(H2O)(������������ͬ)�������ߵķ�Ӧ���� (�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
Cl2�ϳ��л���ʱ�����������HC1��4HCl+O2 2Cl2+2H2O����ʵ���ȵ�ѭ�����á�
2Cl2+2H2O����ʵ���ȵ�ѭ�����á�
���������գ�
��1���÷�Ӧƽ�ⳣ���ı���ʽK= ������Ӧ�������ݻ�Ϊ2L��8min��ﵽƽ�⣬���������������2.5mol������2.25mol����HCl��ƽ����Ӧ����Ϊ mol/L? min��
��2�����÷�Ӧ�����������ܱ������з���������Ӧ��ƽ��ʱ������������ȷ���� ��
a��v (HCl)="2" v(Cl2)
b��4v��(HCl)= v��(O2)
c���ּ���1mol O2������ƽ��ʱ��HCl��ת��������
d�������H2O������ƽ��ʱ��v��(HCl)����
��3����ͼ�Ǹ÷�Ӧ����Ͷ�ϱ�[n (HCl):n (O2)�ֱ�Ϊ4:1��2:1 ] �£���Ӧ�¶ȶ�HClƽ��ת����Ӱ������ߡ�����������ȷ���� ��
a���÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ
b�������������䣬�����¶ȣ�ƽ�ⳣ��Kֵ����
c����ƽ�ⳣ��Kֵ�����ƽ��ǰv��ʼ�ռ�С
d����ƽ�ⳣ��Kֵ�����ƽ��������Ӧ�����ƶ�
��4��Ͷ�ϱ�Ϊ4:1���¶�Ϊ400��ʱ��ƽ��������Cl2�����ʵ��������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ���̶�������ܱ������У��������г���2 mol A ��1 mol B���������·�Ӧ��2A(g) �� B(g)  3C(g) �� D(s)����Ӧ�ﵽƽ��ʱC��Ũ��Ϊ1.2 mol/L.
3C(g) �� D(s)����Ӧ�ﵽƽ��ʱC��Ũ��Ϊ1.2 mol/L.
��1����ʹ�����¶����ߣ�ƽ��ʱ��������ƽ�����Ħ��������С��������ӦΪ________������ȡ����ȡ�����Ӧ��
��2����ά������������¶Ȳ��䣬�����з���������ʼ���ʣ��ﵽƽ��ʱC��Ũ����Ϊ1.2 mol/L����______���������գ���
��4 mol A��2 mol B����3 mol C��1 mol D��l mol B
��3 mol C��2 mol D����1.6 mol A��0.8 mol B��0.6 mol C
��3��ij�¶��£��������м���3 mol C��0.8 mol D����Ӧ�ﵽƽ��ʱC��Ũ����Ϊ1.2 mol/L�����������ݻ�VӦ����________L��С��________L.
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com