
【题目】可逆反应:2NO2![]() 2NO+O2 在定容密闭容器中反应,达到平衡状态的标志是:( )
2NO+O2 在定容密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③NO2、NO、O2 的物质的量浓度变化之比为2 : 2 : 1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥ 混合气体的平均相对分子质量不再改变
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①③④⑤
【答案】A
【解析】①单位时间内生成n molO2是正反应,同时生成2n molNO2是逆反应,且化学反应速率数值之比等于化学计量数之比,故正、逆反应速率相等,①正确;②生成O2和NO都是正反应,故不能确定正、逆反应速率是否相等,②错误;③NO2、NO、O2的物质的量浓度变化之比为2:2:1,等于化学计量数之比,不能确定正、逆反应速率是否相等,③错误;④NO2是红棕色气体,颜色不变时说明NO2的浓度不再变化,已达到化学平衡状态,④正确;⑤气体密度=气体总质量÷容积,始终不变,故不能确定是否平衡,⑤错误;⑥平均分子量=气体总质量÷气体总物质的量,总质量不变,总物质的量会变,故混合气体的平均相对分子质量不再变化时已否达到化学平衡状态,⑥正确。故①④⑥正确,选A。


科目:高中化学 来源: 题型:
【题目】用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术.已知反应Fe2O3+3Na2O2 ![]() 2Na2FeO4+Na2O,下列说法不正确的是( )
2Na2FeO4+Na2O,下列说法不正确的是( )
A.该反应中Na2O2既是氧化剂又是还原剂
B.Na2FeO4既是氧化产物又是还原产物
C.1mol Na2O2发生反应,有2mol电子转移
D.在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 有铜无铁 B. 有铁无铜 C. 铁、铜都有 D. 铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将10 mL pH=1的CH3COOH加水稀释至100 mL后,溶液的pH为( )
A. 2
B. 2<pH<7
C. 1<pH<2
D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应正向反应过程中能量变化如图所示,下列说法正确的是( )

A. 该反应为吸热反应
B. 当反应达到平衡时,降低温度,A的转化率减小
C. 升高温度平衡常数K增大;压强增大,平衡向正反应方向移动
D. 加入催化剂,反应速率增大,反应热不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 通入1 molCl2的新制氯水中,HClO、Cl-、C1O-粒子数之和为2NA
B. 标准状况下,22.4 L CCl4 中所含分子数为 NA
C. 常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA
D. 0.1 mol Fe 和足量的稀硝酸充分反应,转移电子数为 0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
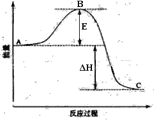
(1)图中E表示__________。E的大小对该反应的反应热_______(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H______(填“变大”、“变小”或“不变”)。
(3)图中△H=___________kJ·mol-1;
(4)当反应达到平衡时,升高温度,反应速率_______ (增大”“减小”或“不变”),SO2的转化率_________ (增大”“减小”或“不变”),原因是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg![]() 与温度(t)的关系曲线如右图。下列说法正确的是( )
与温度(t)的关系曲线如右图。下列说法正确的是( )

A. 通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
B. CO不适宜用于工业冶炼金属Cr
C. CO还原PbO2的反应△H>0
D. 工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com