
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
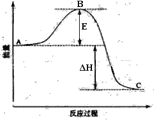
(1)图中E表示__________。E的大小对该反应的反应热_______(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H______(填“变大”、“变小”或“不变”)。
(3)图中△H=___________kJ·mol-1;
(4)当反应达到平衡时,升高温度,反应速率_______ (增大”“减小”或“不变”),SO2的转化率_________ (增大”“减小”或“不变”),原因是______________________
【答案】 正反应活化能 无 不变 -198 增大 减小 该反应为放热反应,升高温度,平衡逆向移动,故SO2转化率减小
【解析】(1)由图可得,E表示正反应的活化能,E与ΔH的数值之和表示逆反应的活化能,ΔH表示反应热,所以E的大小对该反应的反应热无影响。
(2)加入催化剂,改变了反应历程,使反应的活化能降低,活化能的大小对反应热无影响,故△H不变。
(3)1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJmol-1,所以2molSO2(g)氧化为2mol SO3(g)的△H=-198kJmol-1,故图中△H=-198kJmol-1。
(4)升高温度,化学反应速率增大,该反应为放热反应,升高温度,平衡逆向移动,故SO2转化率减小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】写出化学方程式或离子方程式:
(1)碳和浓硫酸反应的化学方程式 .
(2)Na2O2和水反应的离子方程式 .
(3)NH3的催化氧化反应化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在定容密闭容器中反应,达到平衡状态的标志是:( )
2NO+O2 在定容密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③NO2、NO、O2 的物质的量浓度变化之比为2 : 2 : 1
④混合气体的颜色不再改变
⑤混合气体的密度不再改变
⑥ 混合气体的平均相对分子质量不再改变
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图. 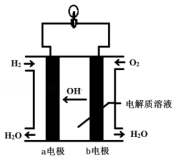
请回答下列问题.
(1)电池是将化学能直接转化为能的装置.
(2)氢氧燃料电池中发生反应的化学方程式是 . 作为碱性氢氧燃料电池,该电池的电解质溶液可以是 .
(3)b 电极上的反应为,则该电极为电池的极.从氧化还原角度分析,该反应属于反应.
(4)氢氧燃料电池与普通电池相比,其优点是(答出一点即可).但作为手机电池,长时间使用时,会感觉手机发烫,这是因为有一部分能量转化为能,所以它还需要解决一些问题,如:手机壳必须多开一个排气孔,可能的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合气体中可能含有Cl2、O2、SO2、NO 、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A.肯定有O2和NO B.肯定没有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应X+3Y2E+2F,在甲、乙、丙、丁四种不同条件下,分别测得反应速率为甲:v(X)=0.3molL﹣1min﹣1 , 乙:v(Y)=0.3molL﹣1min﹣1 , 丙:v(E)=0.4molL﹣1min﹣1 , 丁:v(F)=0.02molL﹣1min﹣1 , 则反应速率最快的是( )
A.甲
B.乙
C.丙
D.丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的用途是利用了它的物理性质的是( )
A. 用乙烯与水加成合成乙醇B. 乙醇(酒精)用作燃料
C. 铜丝用于制作导线D. 二氧化碳做光合作用的原料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com