
【题目】下列物质的用途是利用了它的物理性质的是( )
A. 用乙烯与水加成合成乙醇B. 乙醇(酒精)用作燃料
C. 铜丝用于制作导线D. 二氧化碳做光合作用的原料
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= -99kJ·mol-1。请回答下列问题:
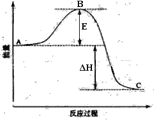
(1)图中E表示__________。E的大小对该反应的反应热_______(填“有”或“无”)影响。
(2)该反应通常用V2O5作催化剂,加V2O5会使图中B点(填“升高”还是“降低”),△H______(填“变大”、“变小”或“不变”)。
(3)图中△H=___________kJ·mol-1;
(4)当反应达到平衡时,升高温度,反应速率_______ (增大”“减小”或“不变”),SO2的转化率_________ (增大”“减小”或“不变”),原因是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg![]() 与温度(t)的关系曲线如右图。下列说法正确的是( )
与温度(t)的关系曲线如右图。下列说法正确的是( )

A. 通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
B. CO不适宜用于工业冶炼金属Cr
C. CO还原PbO2的反应△H>0
D. 工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于淀粉下列叙述中,不正确的是 ( )
A.淀粉属于天然高分子化合物B.遇碘离子能变蓝色
C.淀粉不溶于冷水D.淀粉在人体中能够水解生成葡萄糖,经肠壁吸收进入血液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶甲和乙的混合物,已知甲和乙的某些性质如下表
物质 | 化学式 | 熔点/℃ | 沸点/℃ | 密度/g cm3 | 在水中溶解度 |
甲 | C3H6O2 | -98 | 57.5 | 0.93 | 易溶 |
乙 | C4H8O2 | -84 | 77 | 0.90 | 易溶 |
据此,将甲和乙互相分离的最佳方法是
A. 蒸馏 B. 过滤 C. 萃取 D. 分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以用来说明甲烷的化学性质相对比较稳定的事实是( )
A. 甲烷不能使酸性高锰酸钾溶液褪色B. 甲烷不与强酸反应
C. 甲烷不与强碱反应D. 综合以上事实才可以说明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案可行的是( )
A. 用浓硫酸干燥氨气 B. 通入Cl2除去FeCl3溶液中的FeCl2
C. 用酚酞试液检验酸性溶液 D. 加入Fe粉除去Al3+溶液中的杂质Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl2===2HCl的化学反应可用下图表示:

请回答下列有关问题:
(1)反应物断键吸收的总能量为________。
(2)生成物成键放出的总能量为________。
(3)判断H2+Cl2===2HCl是________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”,“=”或“<”)生成物的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com