
 ,故答案为:Al;
,故答案为:Al; ;
;

 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
| A、46g有机物C2H6O中含有的H-O键的数目为NA |
| B、常温下,2L 1mol?L-1的乙酸溶液中,所含分子总数小于2NA |
| C、标准状况下,5.6L NO和5.6L O2组成的混合气体中所含原子数为NA |
| D、18g D2O含有的电子总数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
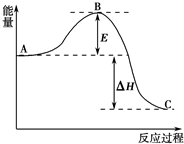 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3+3H2O═Fe(OH)3↓+3HCl |
| B、Zn+2HCl═ZnCl2+H2↑ |
| C、3Zn+2FeCl3═3ZnCl2+2Fe |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn+CuSO4=ZnSO4+Cu | ||||
B、CuO+CO
| ||||
| C、Na2CO3+2HCl=2NaCl+H2O+CO2↑ | ||||
D、2KClO3
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com