
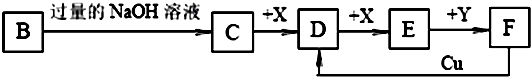
| 0.4×0.4×0.2 |
| 1×1×0.8×0.8 |
| 1×0.4×0.4 |
| 1.6×1.6×1×1 |
| 1 |
| 16 |
| 1 |
| 20 |


科目:高中化学 来源: 题型:
(14分)已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质;Y在常温下为液态,E的相对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去):
请回答下列问题:
(1)B的化学式为 ;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2 反应生成HCl和物质A,A可发生水解反应生成NH3 和HClO,则C与过量Cl2 反应的化学方程式为 ,反应中的还原剂为 ;
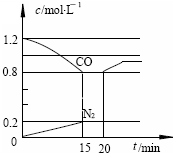
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g) + 2CO(g) N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
①该反应的化学平衡常数为 K = ;
②若保持温度不变,20 min 时再向容器中充入CO、N2
各0.8 mol,平衡将 移动(填“向左”、 “向右”或“不”)
③20min时,若改变反应条件,导致CO浓度发生如图
所示的变化,则改变的条件可能是 (填序号);
a.缩小容器体积 b.增加CO2 的量
c.升高温度 d.加入催化剂
查看答案和解析>>
科目:高中化学 来源:2012届山东省青岛市高三统一质量检测理科综合(化学部分) 题型:填空题
(14分)已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质;Y在常温下为液态,E的相对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去):
请回答下列问题:
(1)B的化学式为 ;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2反应生成HCl和物质A,A可发生水解反应生成NH3 和HClO,则C与过量Cl2 反应的化学方程式为 ,反应中的还原剂为 ;
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g) + 2CO(g)  N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
①该反应的化学平衡常数为 K = ;
②若保持温度不变,20 min 时再向容器中充入CO、N2
各0.8 mol,平衡将 移动(填“向左”、“向右”或“不”)
③20 min时,若改变反应条件,导致CO浓度发生如图
所示的变化,则改变的条件可能是 (填序号);
a.缩小容器体积 b.增加CO2的量
c.升高温度 d.加入催化剂
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省青岛市高三统一质量检测理科综合(化学部分) 题型:填空题
(14分)已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质;Y在常温下为液态,E的相对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去):

请回答下列问题:
(1)B的化学式为 ;F与Cu反应的离子方程式为_________;
(2)C可与过量的Cl2 反应生成HCl和物质A,A可发生水解反应生成NH3 和HClO,则C与过量Cl2 反应的化学方程式为 ,反应中的还原剂为 ;
(3)D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g) + 2CO(g)  N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2
mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2
mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
①该反应的化学平衡常数为 K = ;
②若保持温度不变,20 min 时再向容器中充入CO、N2
各0.8 mol,平衡将 移动(填“向左”、 “向右”或“不”)
③20 min时,若改变反应条件,导致CO 浓度发生如图
所示的变化,则改变的条件可能是 (填序号);

a.缩小容器体积 b.增加CO2 的量
c.升高温度 d.加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com