
| 编 号 | а取值范围 | 产物化学式(离子符号) |
| ① | I2、Br- | |
| ② | $\frac{1}{6}$<а<1/5 | |
| ③ | I2、IO3-、Br2 | |
| ④ |
分析 (1)根据题干信息可知,发生反应的方程式有:KBrO3+6KI+3H2SO4═3I2+KBr+3K2SO4+3H2O、2KBrO3+10KI+6H2SO4═5I2+Br2+6K2SO4+6H2O、6KBrO3+5KI+3H2SO4═5KIO3+3Br2+3K2SO4+3H2O,根据反应方程式确定a的范围及产物;
(2)碘单质和碘酸钾的物质的量相等,碘单质和碘酸钾的物质的量为:$\frac{1mol}{3}$=$\frac{1}{3}$mol,然后根据反应10KI+2KBrO3+6H2SO4=5I2+Br2+6K2SO4+6H2O和5KI+6KBrO3+3H2SO4=5KIO3+3Br2+3K2SO4+3H2O计算a值.
解答 解:(1)根据题干信息可知,发生反应的方程式有:KBrO3+6KI+3H2SO4═3I2+KBr+3K2SO4+3H2O、2KBrO3+10KI+6H2SO4═5I2+Br2+6K2SO4+6H2O、6KBrO3+5KI+3H2SO4═5KIO3+3Br2+3K2SO4+3H2O,
①当a≤$\frac{1}{6}$时,KBrO3不足,反应生成I2、Br-,反应方程式为:6KI+KBrO3+3H2SO4=3I2+KBr+3K2SO4+3H2O,则产物为:I2、Br-;
②当 $\frac{1}{6}$<a<$\frac{1}{5}$时发生反应:KBrO3+6KI+3H2SO4═3I2+KBr+3K2SO4+3H2O、2KBrO3+10KI+6H2SO4═5I2+Br2+6K2SO4+6H2O,反应产物为:I2、Br-、Br2;发生的反应具有A又有B的反应;
④当a≥$\frac{5}{6}$时,KBrO3足量,发生反应为:5KI+6KBrO3+3H2SO4=5KIO3+3Br2+3K2SO4+3H2O,所以反应产物为:IO3-、Br2;
③当 $\frac{1}{5}$<a<$\frac{5}{6}$时,反应按照反应2KBrO3+10KI+6H2SO4═5I2+Br2+6K2SO4+6H2O、6KBrO3+5KI+3H2SO4═5KIO3+3Br2+3K2SO4+3H2O进行,反应产物为:I2、IO3-、Br2,
故答案为:
| 编 号 | а 的取值范围 | 产物的化学式(离子符号) |
| ① | a≤1/6 | I2、Br- |
| ② | 1/6<а<1/5 | I2、Br-、Br2 |
| ③ | 1/5<а<6/5 | I2、IO3-、Br2 |
| ④ | A≥6/5 | IO3-、Br2 |
点评 本题考查了有关范围讨论的化学计算,题目难度较大,根据题干信息正确判断各物质的氧化性强弱为较大关键,要求学生能够根据氧化性强弱正确书写发生反应的化学方程式.


科目:高中化学 来源: 题型:选择题
| A. | 一滴香: | B. | 芬必得: | ||
| C. | 维生素B5: | D. | 扑热息痛: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时电解池的阳极一定是阴离子放电 | |
| B. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行:则该反应的△H>0 | |
| C. | 其他条件不变,增大压强,平衡可能移动,但平衡常数一定不变 | |
| D. | 铁制品表面镶锌块和铁制品表面镀锡,都能起到防腐的作用且防腐原理是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | FeCl2 | C. | Fe(OH)3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量NaCl固体 | B. | 加少量NaOH | C. | 加少量CuSO4固体 | D. | 加少量Na2S固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: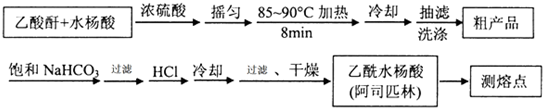
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
 .
.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com