
| A. | c(A-)≥c(M+) | B. | c(A-)≤c(M+) | ||
| C. | 若MA不水解,则c(OH-)=c(A-) | D. | 若MA水解,则c( OH-)>c(A-) |
分析 一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应生成MA,如果HA是弱酸,二者生成的盐是强碱弱酸盐,其溶液呈碱性;如果HA是强酸,生成的盐是强酸强碱盐,其溶液呈中性,据此分析解答.
解答 解:一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应生成MA,如果HA是弱酸,二者生成的盐是强碱弱酸盐,其溶液呈碱性;如果HA是强酸,生成的盐是强酸强碱盐,其溶液呈中性,
A.如果呈强酸,溶液呈中性,则c(A-)=c(M+);如果是弱酸,混合溶液呈碱性,则c(A-)<c(M+),所以混合溶液中存在c(A-)≤c(M+),故A错误;
B.根据A知,混合溶液中存在c(A-)≤c(M+),故B正确;
C.如果MA不水解,水的电离程度远远小于盐的电离程度,所以c(OH-)<c(A-),故C错误;
D.若MA水解,但其水解程度较小,所以水的电离程度还是远远小于盐的电离程度,则c(OH-)<c(A-),故D错误;
故选B.
点评 本题考查离子浓度大小比较,为高频考点,正确判断溶液中溶质性质是解本题关键,注意:含有弱离子的盐能水解,但其程度较小,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 呵护生存环境,共建和谐社会.
呵护生存环境,共建和谐社会.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HSO4-、Na+、OH-、K+ | B. | HCO3-、NO3-、Mg2+、Ba2+ | ||
| C. | Ba2+、Mg2+、NO3-、Cl- | D. | Mg2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
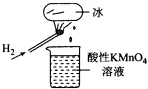
| A. | 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 | |
| B. | 该条件下H2燃烧的产物中可能含有一定量的H2O2、HO2等 | |
| C. | 将烧杯中溶液换成KI淀粉溶液也能验证生成物具有还原性 | |
| D. | 酸性FeSO4溶液中加入双氧水的离子反应为:2Fe 2++H2O2+2H+=2Fe3++2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编码 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先融化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔融化,失去光泽,融化的铝并不滴落,好像一层膜兜着 |
| C | 在空气中久置的铝条放入NaOH溶液中 | 铝条立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.
目前流行的关于生命起源假设的理论认为,生命起源于约40亿年前的古洋底的热液环境,这种环境系统中普遍存在铁硫簇结构,如Fe2S2、Fe4S4、Fe8S7等,这些铁硫簇结构参与了生命起源的相关反应.某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验.| 滴定次数 | 待测溶液体积/mL | 草酸溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.50 | 23.70 |
| 2 | 25.00 | 1.02 | 26.03 |
| 3 | 25.00 | 0.00 | 24.99 |
| 编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
| 1 | 25 | 5.0 | 2.0 | 40 |
| 2 | 25 | 5.0(另加少量可溶于水的MnSO4粉末) | 2.0 | 4 |
| 3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应时,1 mol Na2O2转移1 mol电子 | |
| B. | 78gNa2O2含有阴、阳离子总数是4NA | |
| C. | 1mo1•L-1的AlC13溶液中,C1-离子的数目为3 NA | |
| D. | 5.6 g铁与足量盐酸反应转移的电子数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com