
| A. | Na2O2与水反应时,1 mol Na2O2转移1 mol电子 | |
| B. | 78gNa2O2含有阴、阳离子总数是4NA | |
| C. | 1mo1•L-1的AlC13溶液中,C1-离子的数目为3 NA | |
| D. | 5.6 g铁与足量盐酸反应转移的电子数为0.3 NA |
分析 A、过氧化钠与水的反应为歧化反应;
B、求出过氧化钠的物质的量,然后根据1mol过氧化钠中含2mol钠离子和1mol过氧根来分析;
C、溶液体积不明确;
D、求出铁的物质的量,然后根据铁与盐酸反应后变为+2价来分析.
解答 解:A、过氧化钠与水的反应为歧化反应,1mol过氧化钠中的1mol-1价的氧原子由-1价变为0价,故转移1mol电子,故A正确;
B、78g过氧化钠的物质的量为1mol,而1mol过氧化钠中含2mol钠离子和1mol过氧根,故含3mol离子即3NA个,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、5.6g铁的物质的量为0.1mol,而铁与盐酸反应后变为+2价,故0.1mol铁失去0.2mol电子即0.2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | c(A-)≥c(M+) | B. | c(A-)≤c(M+) | ||
| C. | 若MA不水解,则c(OH-)=c(A-) | D. | 若MA水解,则c( OH-)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
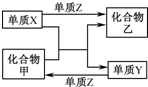 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | X | Y | Z | 甲 | 乙 |
| A | Fe | H2 | O2 | H2O | Fe3O4 |
| B | Mg | C | O2 | CO2 | MgO |
| C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
| D | Cl2 | N2 | H2 | NH3 | HCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、AlO2- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | NH4+.、Mg2+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界无热量交换)密闭容器中进行该反应,化学平衡常数改变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO, 反应达到平衡前的速率:v(正)>v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com