
【题目】Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
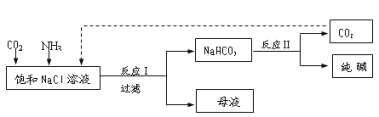
已知NaHCO3在低温下溶解度较小。
(1)反应Ⅰ的化学方程式为______。
(2)处理母液的两种方法:
①向母液中加入石灰乳,反应的化学方程式为____,目的是使____循环利用。
②向母液中____并降温,可得到NH4Cl晶体。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
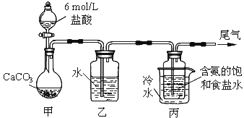
(3)装置丙中冷水的作用是______;由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、洗涤、灼烧。
(4)若灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。
取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。曲线c对应的溶液中的离子是____(填离子符号);该样品中NaHCO3和Na2CO3的物质的量分别是___mol、___mol。
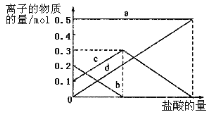
【答案】NaCl+CO2+NH3+H2O →NaHCO3↓+NH4Cl 2NH4Cl +Ca(OH)2→CaCl2+2NH3↑+2H2O NH3 通入NH3,加入细小的食盐颗粒 冷却,使碳酸氢钠晶体析出 过滤 HCO3- 0.1 0.2
【解析】
(1)由于NaHCO3在低温下溶解度较小,溶液中含有较大浓度的钠离子和碳酸氢根离子时,就会有碳酸氢钠晶体析出,所以饱和氯化钠中溶液中通入NH3和CO2发生反应的方程式为:NaCl+CO2+NH3+H2O →NaHCO3↓+NH4Cl;答案:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(2)①根据题中反应流程可知,过滤后得到的母液中含有氯化铵,母液中加入石灰乳后,发生反应为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,反应生成氨气,氨气可以在反应流程中循环利用;答案:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;NH3;
②由反应NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨能电离铵根离子,铵根离子浓度增大有利于氯化铵析出。
答案:通入NH3,加入细小的食盐颗粒。
(3)由装置丙中产生的是NaHCO3,其溶解度随温度降低而降低,所以装置丙中冷水的作用是:冷却,使碳酸氢钠晶体析出;制取Na2CO3时需要过滤得到晶体,洗涤后加热灼烧得到碳酸钠;答案:冷却,使碳酸氢钠晶体析出;过滤;
(4)若在(2)中灼烧的时间较短, NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应CO32-+H+=HCO3-;HCO3-+ H+=CO2![]() +H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸氢根离子物质的量变化。碳酸根离子物质的量为0.2mol,碳酸氢根离子物质的量为0.1mol;所以样品中NaHCO3的物质的量为0.1mol,Na2CO3的物质的量为0.2mol;
+H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸氢根离子物质的量变化。碳酸根离子物质的量为0.2mol,碳酸氢根离子物质的量为0.1mol;所以样品中NaHCO3的物质的量为0.1mol,Na2CO3的物质的量为0.2mol;
因此,本题正确答案是: HCO3-;0.1;0.2。


科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确是( )
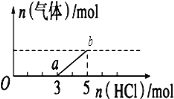
A.oa段反应的离子方程式为:H++OH-=H2O
B.O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。
ZnO(s)+2Ni(OH)2(s)。

A. 三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B. 充电时阳极反应为Ni(OH)2(s)+OH(aq)e![]() NiOOH(s)+H2O(l)
NiOOH(s)+H2O(l)
C. 放电时负极反应为Zn(s)+2OH(aq)2e![]() ZnO(s)+H2O(l)
ZnO(s)+H2O(l)
D. 放电过程中OH通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 石油的催化重整可以得到芳香烃,说明石油中含有芳香烃
B. 煤的干馏和石油裂解得到的产物相同
C. 石油分馏得到的产物可用来萃取溴水中的溴
D. 聚丙烯塑料的结构简式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘。向反应后的溶液中滴入酚酞,溶液变为红色。
(1)试写出该反应的化学方程式(Ⅰ):_____。
(2)该反应体系中还伴随着化学反应(Ⅱ):I2(aq) + I-(aq)![]() I3-(aq)。反应Ⅱ的平衡常数表达式为:____。
I3-(aq)。反应Ⅱ的平衡常数表达式为:____。
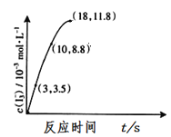
(3)根据如图,计算反应Ⅱ中3-18s内用I2表示的反应速率为_____。
(4)为探究Fe2+对上述O3氧化I-反应的影响,将O3通入含Fe2+和I-的混合溶液中。试预测因Fe2+的存在可能引发的化学反应(请用文字描述,如:“碘离子被臭氧氧化为碘单质”)① ______。② _____;该反应的过程能显著降低溶液的pH,并提高反应(Ⅰ)中Ⅰ-的转化率,原因是:____ 。
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后以淀粉为指示剂,用一定浓度的I2溶液进行滴定。综合上述各步反应及已有知识,可推知氧化性强弱关系正确的是____(填序号)。
a. Fe3+> I2 b. O3> Fe3+ c. I2> O2 d. I2>SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应方程式如下:Na2SO4+4C →Na2S+ 4CO,Na2SO4+4CO→Na2S+4CO2
(1)现有无水芒硝17.75g,若生成过程中无水芒硝的利用率为80%,则理论上可得到Na2S_____g,最多生成标况下的CO_____L。
(2)若在反应过程中生成的Na2S3mol,则消耗的碳单质的物质的量 n的范围是____mol≤n≤___mol,若生成等物质的量CO和CO2,则消耗的碳的物质的量为____mol。
(3)Na2S放置在空气中,会被缓慢氧化成Na2SO4及 Na2SO3,现称取已经部分氧化的硫化钠样品78.40g溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L(标准状况)。请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.磷酸溶于水的电离方程式:H3PO4=3H+ + PO43-
B.用电子式表示 HCl 的形成过程:![]()
C.S2-的结构示意图:
D.KClO 碱性溶液与Fe(OH)3反应:3ClO- + 2Fe(OH)3=2FeO42- + 3Cl- + 4H+ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】模拟电渗析法将海水淡化的工作原理示意图如下。己知X、Y均为惰性电极,模拟海水中富含Na+、Cl—、Ca2+、Mg2+、SO42—等离子。下列叙述中不正确的是

A.N是阴离子交换膜
B.Y电极上产生有色气体
C.X电极区域有浑浊产生
D.X电极反应式为4OH——4e—=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固态或气态碘分别与氢气反应的热化学方程式如下:
①H2(g)+I2(?)![]() 2HI(g) ΔH1=-9.48 kJ·mol-1
2HI(g) ΔH1=-9.48 kJ·mol-1
②H2(g)+I2(?)![]() 2HI(g) ΔH2=+26.48 kJ·mol-1
2HI(g) ΔH2=+26.48 kJ·mol-1
下列判断不正确的是( )
A.①中的I2为气态,②中的I2为固态
B.②的反应物总能量比①的反应物总能量低
C.反应①的产物比反应②的产物热稳定性更好
D.1 mol固态碘升华时将吸热35.96 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com