
����Ŀ���״�ȼ�ϵ�����ڽṹ������ת���ʸߡ��Ի�������Ⱦ������Ϊ������Դ�����Ʒ��Խ��Խ�ܵ���ע���乤��ʾ��ͼ���£����ܷ�ӦΪ 2CH3OH��3O2===2CO2��4H2O������˵������ȷ����( )
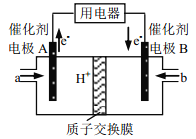
A. �缫 A �Ǹ��������� a Ϊ�״�
B. ��ع���ʱ�����Һ�е� H��ͨ�����ӽ���Ĥ�� B �缫Ǩ��
C. �ŵ�ǰ��������Һ�� pH ����
D. b �����ڵ缫�Ϸ����ĵ缫��ӦʽΪ�� O2+4e��+2H2O��4OH��
���𰸡�D
���������״���ȼ�ϵ�أ��״��ڸ�������������������������ԭ��������A����������������B���缫A �Ǹ��������� a Ϊ�״���A��ȷ��H��Ӧ����������B �缫���ƶ���B��ȷ��������Ӧ��2CH3OH-12e��+2H2O=2CO2+12H��,������Ӧ 3O2+12e��+12H����6H2O����Ӧǰ��H������û�䣬���Ƿ�Ӧ��������ˮ�������H����Ũ�ȼ�С���������Һ�� pH ����C��ȷ�����Ի����£�������B�缫�Ϸ����ĵ缫��ӦʽΪ�� O2+4e��+4H����2H2O ��D������ȷѡ��D��


 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ���ܿ������齫�������̺�����������һ������ֽ�Ƴɵ���ֽͨ�����γɵ��(��ͼ��ʾ)���õ�ؿɽ�����(pH=2.5)�е���������Ϊȼ��ת�����������������������������˵����ȷ����( )

A. a������
B. ���ŷ�Ӧ���Ͻ��У���������pH��������
C. b���ĵ缫����Ϊ:MnO2+2H2O+2e-=Mn2++4OH-
D. ������0.01mol������ʱ����·��ת��0.02mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D�����ֳ������л������A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ�����չˮƽ��B��C��Ũ����ͼ��������·�����Ӧ�����ɵ��л�����������ζ��A��B��C��D��һ�������µ�ת����ϵ��ͼ��ʾ����Ӧ������ʡ�ԣ���

��1��B�Ľṹ��ʽΪ______________��C�й����ŵ�����Ϊ__________��
��2����ϩ�ᣨCH2��CH��COOH�������ʿ�����_______________������ѡ��
A���ӳɷ�Ӧ B��ȡ����Ӧ C���кͷ�Ӧ D��������Ӧ
��3����һ�ַ�������B��C�������Լ���___________________��
��4����ϩ�������Ľṹ��ʽΪ_______________��
��5��д�����з�Ӧ����ʽ���л���Ӧ�������ͣ�
��___________________________��___________��Ӧ��
��___________________________��___________ ��Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����( )
A. ϡ������Һ������������Һǡ���кͣ� Ba2++OH��+H++SO42����BaSO4��+H2O
B. ������Ͷ������þ��Һ�У� 2Na+2H2O +Mg2+��2Na++H2��+Mg(OH)2��
C. ̼������Һ��ͨ����������� CO32��+Cl2��CO2��+Cl��+ClO��
D. ʵ������ MnO2 ��Ũ������ȡ Cl2�� MnO2+4HCl(Ũ) ![]() Mn2++2Cl��+Cl2��+2H2O
Mn2++2Cl��+Cl2��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���ͬ�ڵ�һ���֣� A��B��C��D��E����Ԫ�������ڱ��е�λ������ͼ��ʾ��CԪ�ص�ԭ������������Ϊ������3����
A | E | C | |
B | D |
�ش��������⣺
��1��BԪ�������ڱ��е�λ��Ϊ__________��
��2��D������������Ӧˮ����Ļ�ѧʽΪ__________��
��3��������ʵ��˵��CԪ�صķǽ����Ա���Ԫ�صķǽ�����ǿ����__________��
a��C������H2S��Һ��Ӧ����Һ�����
b����������ԭ��Ӧ�У�1molC���ʱ�1molS�õ��Ӷ�
c��C��S��Ԫ�صļ��⻯�����ȷֽ⣬ǰ�ߵķֽ��¶ȸ�
d. CԪ�صļ��⻯��е����SԪ�صļ��⻯��
��4��B��D��Ԫ�صĵ��ʷ�Ӧ���ɻ�����M�����Ľṹ���Ƽ��飬д��M�ĵ���ʽ_____��
��5��A��þ�γɵ�1mol������N��ˮ��Ӧ������2molMg(OH)2��1mol��̬��������������̼��������Ϊ9:1��д��N��ˮ��Ӧ�Ļ�ѧ����ʽ______________________________��
��6��ͭ��һ��Ũ�ȵ����������Ļ���ᷴӦ�����ɵ���ֻ������ͭ��ͬʱ���ɵ�����������ɱ�������Ԫ����ɣ��������Է���������С��50��Ϊ��ֹ��Ⱦ����������������ȫת��Ϊ��ۺ������Σ�����1L2.2mol/LNaOH��Һ��1molO2������������ķ���ʽ�����ʵ����ֱ�Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�� H3A ˮ��Һ(һ������Һ)�к� A �ĸ������ӵķֲ�������ƽ��ʱij�����ӵ�Ũ��ռ��������Ũ��֮�͵ķ����������� pH �Ĺ�ϵ��ͼ��ʾ������������ȷ����( )
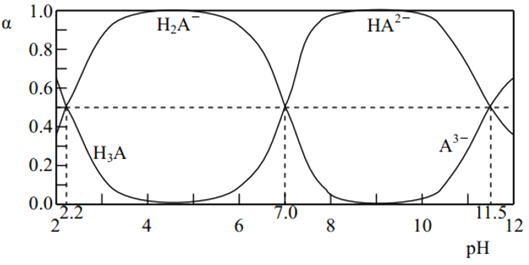
A. ����ͼ���ɵ� Ka1(H3A )��10��7
B. �������ʵ����� NaH2A �� Na2HA ���������ˮ�����õ���Һ�� ��(H2A��)����(HA2-)
C. �Է�̪Ϊָʾ������ɫ��Χ pH 8.2��10.0������ NaOH ��Һ��μ��뵽 H3A ��Һ�У�����Һ����ɫ��Ϊdz��ɫʱֹͣ�μӣ������� NaH2A
D. �������� A �ĸ������ӵ���ϵ�У��� c(H2A��)��5c(A3��)��c(OH��)��c(H+)������ҺpHΪ11.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��ԭ�ӵ�����������Ϊ������������3�������Ԫ��ԭ�Ӻ���������Ϊ(����)
A.3B.8
C.10D.7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ǽ��㶹����һ�����Ƶ���ʯ��ҩ���ṹ��ʽ��ͼ��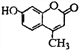 ����˵������ȷ����
����˵������ȷ����
A. �Ǽ��㶹�ط���ʽΪC10H8O3
B. 1mol�Ǽ��㶹����������5mol H2�����ӳ�
C. 1mol�Ǽ��㶹����������NaOH��Һ����������3mol NaOH
D. �Ǽ��㶹�ط����к������������ǻ���̼̼˫�������ڷ����廯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ѧϰС���ͬѧ��������������ԭ��Ӧ���ԭ��أ�2KMnO4+10FeSO4+8H2SO4�T2MnSO4+5Fe2��SO4��3+K2SO4+8H2O������װ�б���K2SO4��Һ��������������ȷ���ǣ�������
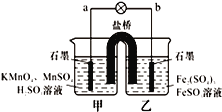
A. ���·�ĵ��������Ǵ�a��b
B. ���ձ�����Һ��pH��С
C. ��ع���ʱ�������е�SO42-������ձ�
D. ���ձ��з�����ԭ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com