
【题目】某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。

(1)当有1molNa+通过阳离子交换膜时,a极生成气体__________L(标准状况),阳极的电极反应式是______________________________。
(2)稀NaOH溶液的作用是____________,B处流出较浓的NaOH溶液,C处流出的是________________。
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40m3,理论上需要消耗甲烷___________m3。
【答案】 11.2 SO32- -2e-+H2O==SO42- +2H+ 增强溶液导电性 较浓的硫酸 2
【解析】根据装置图中正负极和溶液中离子的移动方向及放电能力,即可判断出两极产物,进而写出电极反应式;由于水中离子浓度很小,所以稀NaOH溶液和稀硫酸的作用都是增强溶液的导电性;根据电子转移守恒,可计算出消耗甲烷的体积。
(1) 当有1mol Na+通过阳离子交换膜时,即电路中通过1mol电子,在阴极放出H2在标准状况下的体积为11.2L;而在阳极上SO32-放电生成SO42-,电极反应式为SO32--2e-+H2O==SO42-+2H+。
(2)由于水中离子浓度很小,所以用稀NaOH溶液和稀硫酸增强溶液的导电性,提高工作效率;根据阳极反应式可知,从C处流出的物质是较浓的硫酸。
(3)处理含SO2 20%(体积分数)的废气40m3,则n(SO2)=[40×103L×20%]/22.4L/mol= 8000/22.4mol,则转移电子n(e-)=8000/11.2mol,而1molCH4在燃料电池中反应生成1mol CO2转移8mol电子,所以理论上需要消耗甲烷的体积为![]() ×10-3m3/L =2 m3。
×10-3m3/L =2 m3。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验验证元素周期律。
Ⅰ.甲同学在a、b、c、d四只烧杯中分别加入50 mL冷水,再各滴加几滴酚酞试液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象。
(1)甲同学设计实验的目的是验证:同一主族,从上到下金属元素的原子失电子能力逐渐增强;同一周期,从左到右金属元素的原子失电子能力逐渐___________________;
(2)反应最剧烈的烧杯中金属是_______(填字母序号);
A.钠 B.镁 C.铝 D.钾
(3)实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验目的,请你帮助选择下列合适的方法_________(填字母序号)。
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
Ⅱ.乙同学设计实验探究碳、硅元素的非金属性的相对强弱。根据要求完成下列各题
(1)实验装置:

(1)填写所示仪器名称:B__________
(2)实验步骤:
连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________________;试管F中发生反应的离子方程式为_____________________。
③依据试管 D 中的反应,能否证明S的非金属性强于C的非金属性___(填 “能”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研机构用NaOH溶液吸收硫酸工业废气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。

(1)当有1molNa+通过阳离子交换膜时,a极生成气体__________L(标准状况),阳极的电极反应式是______________________________。
(2)稀NaOH溶液的作用是____________,B处流出较浓的NaOH溶液,C处流出的是________________。
(3)在标准状况下,若用甲烷-空气燃料电池做电源,处理含SO2 20%(体积分数)的废气40m3,理论上需要消耗甲烷___________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能使反应速率加快,下列叙述正确的是( )
A. 降低反应所需的活化能
B. 对于吸热反应、放热反应,反应速率同等程度加大
C. 体系中活化分子总数不变
D. 使反应体系的活化分子百分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片。下列叙述不正确的是( )
A. 铜片上有H2逸出 B. 电子通过导线由铜片流向锌片
C. 反应一段时间后,溶液的H+ 浓度降低 D. 负极附近的SO42-离子浓度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)科研人员设想用如图所示装置生产硫酸。
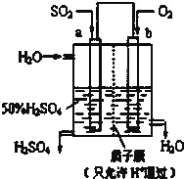
①上述生产硫酸的总反应方程式为_____,b是_____极,a电极反应式为_____,生产过程中H+向_____(填a或b)电极区域运动。
②该小组同学反思原电池的原理,其中观点正确的是_____(填字母)。
A.原电池反应的过程中可能没有电子发生转移
B.原申池装置需要2个活泼性不同的金属电极
C.电极一定不能参加反应
D.氧化反应和还原反应可以拆开在两极发生
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成原电池装置,则负极材料为_____,溶液C为_____。
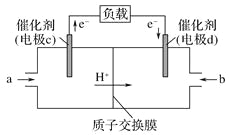
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜(只允许H+通过)燃料电池的结构示意图如:电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_____(填“正极”或“负极”),c电极反应方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,断裂1molN≡N吸收942kJ热量.根据以上信息和数据,下列说法正确的是( )

A. N4属于一种新型的化合物,与N2互为同素异形体
B. N4的沸点比白磷(P4)的高
C. 1mol N4转化为2mol N2的同时放出能量
D. 相同质量的N4和 N2所含原子个数比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com