
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO(g)+O2(g) =2CO2(g)反应的ΔH=—(2×283.0)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液的物质的量浓度的计算正确的是
A. 标准状况下,a L NH3溶于1000 g水中,得到的溶液密度为b gcm-3,(考虑溶液体积变化)则该溶液的物质的量浓度为![]() molL-1
molL-1
B. 将100 mL 1.5 molL-1的NaCl溶液与200 mL 2.5 molL-1的NaCl溶液混合(忽略溶液体积变化),得到溶液的物质的量浓度为2 molL-1
C. V L Fe2(SO4)3溶液中含Fe3+m g,溶液中c(SO42-)是![]() molL-1
molL-1
D. 某温度时,饱和NaCl溶液的密度为ρ gcm-3,物质的量浓度为cmol/L,该溶液中NaCl的质量分数为![]() ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的有机原料,在催化剂的作用下,CO和H2反应可生成甲醇 (CH3OH) 和副产物CH4,反应如下:
反应①CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.0kJ/mol
CH3OH(g) △H1=-90.0kJ/mol
反 应②CO(g)+3H2(g)![]() CH4(g) + H2O(g) △H2
CH4(g) + H2O(g) △H2
反应③ CH4(g)+2H2O(g)![]() CO2(g)+ 4H2(g) △H3=+125.0 kJ/mol
CO2(g)+ 4H2(g) △H3=+125.0 kJ/mol
反应④CO(g)+ H2O(g)![]() CO2(g) + H2(g) △H4=-25.0 kJ /mol
CO2(g) + H2(g) △H4=-25.0 kJ /mol
K1、K2、K3、K4分别表示反应①、②、③、④的平衡常数。
回答下列问题:
(1)反应②的平衡常数的表达式为K2=______________,K2与K3和K4的关系为K2=______________,△H2=____________kJ/mol。
(2)图1中能正确表示反应①的平衡常数(lgK1) 随温度变化的曲线为______________(填曲线字母),其判断理由为______________________________________________________________。

(3)恒温恒容的条件下,下列情况能说明反应①达到平衡状态的是__________________。
A.2v正 (H2)=v逆(CH3OH) B.混合气体的密度不再改变
C.混合气体的平均摩尔质量不再改变 D.混合气体的压强不再改变
(4)为探究不同催化剂对CO和H2生成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1∶3进行实验,得到如下数据:
T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
450 | 10 | CuO-ZnO | 78 |
450 | 10 | CuO-ZnO-ZrO2 | 88 |
450 | 10 | ZnO-ZrO2 | 46 |

①由表1可知,反应①的最佳催化剂为______________,图2中a、b、c、d四点是该温度下CO平衡转化率的是_________________________________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有_________________。
A.使用催化剂CuO-ZnO-ZrO2 B.适当降低反应温度
C.增大CO和H2的初始投料比 D.恒容下,再充入a molCO和3a mol H2
(5)已知1000℃,反应CO(g)+ H2O(g)![]() CO2(g) + H2(g) K4=1.0。该温度下,在某时刻体系中CO、H2O、CO2、H2的浓度分别为3molL-1、1molL-1、4molL-1、2molL-1,则此时上述反应的v正(CO)_______v逆(CO) (填“>”、“<”或“=”)达到平衡时c(CO)=___________ molL-1。
CO2(g) + H2(g) K4=1.0。该温度下,在某时刻体系中CO、H2O、CO2、H2的浓度分别为3molL-1、1molL-1、4molL-1、2molL-1,则此时上述反应的v正(CO)_______v逆(CO) (填“>”、“<”或“=”)达到平衡时c(CO)=___________ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 molCaCl2溶解于水配成2 L溶液,所得溶液物质的量浓度是( )
A. 0.5 mol/L B. 1 mol/L C. 2 mol/L D. 4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成 A、B 两室,向 A 中充入一定量 H2、O2 的混合气体,向 B 中充入 1 mol 空气,此时活塞的位置如图所示。

(1)A 室混合气体的物质的量为______,所含分子总数约______。
(2)实验测得 A 室混合气体的质量为 34 g,则该混合气体的密度是同温同压条件下氦气密度的______倍。
(3)若将 A 室 H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在______刻度,容器内气体压强与反应前气体压强之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型钙钛矿太阳能电池是近几年来的研究热点,具备更加清洁、便于应用、制造成本低和效率高等显著优点,其中一种钙钛矿太阳能电池材料的晶胞如图。回答下列问题:
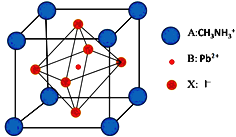
(1)铅或铅盐的焰色反应为绿色,下列有关原理分析的叙述正确的是_________(填字母)。
a.电子从基态跃迁到较高的激发态 b.电子从较高的激发态跃迁到基态
c.焰色反应的光谱属于吸收光谱 d.焰色反应的光谱属于发射光谱
(2)碳原子价层电子的轨道表达式(电子排布图)为_________。基态Pb原子核外电子排布,最后占据能级的电子云轮廓图形状为___________。
(3)CH3NH3+中含有化学键的类型有________(填字母序号),N原子的杂化形式为______,与CH3NH3+互为等电子体的分子为_________
a.极性键 b. 非极性键 c.配位键 d. 离子键 e.σ键 f.π键
(4)NH4+中H—N—H的键角比NH3中H -N-H的键角大的原因是__________;NH3和水分子与铜离子形成的化合物中阳离子呈轴向狭长的八面体结构(如右图),该化合物加热时首先失去水,请从原子结构角度加以分析:__________。
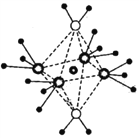
(5)与I- 紧邻的I- 个数为__________。X射线衍射实验测得晶胞参数:密度为a g·cm-3,则晶胞的边长为____________pm(该物质的相对原子质量为M,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
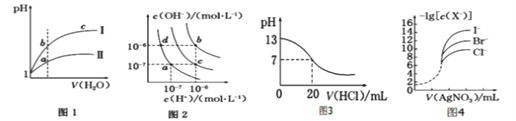
A. 图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强
B. 图2 中纯水仅升高温度,不能使a点变到c点
C. 图3 表示25 ℃时,用0.100 0 molL-1HCl 滴定20 mL 0.100 0 molL-1NaOH 溶液,溶液的pH随加入盐酸体积的变化
D. 用0.010 0 molL-1AgNO3标准溶液滴定浓度均为0.100 0 molL-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含磷化合物在生产生活中有着重要的应用。
(1)磷与氨是同主族元素,下列能说明者非金属性强弱的是_______(填字母)。
a.NH3比PH3稳定性强
b.常温下,氮气为气体,磷单质为固体
c.氮气与氢气化合比磷与氢气化合更困难
d.HNO3的酸性比HPO3酸性强
(2)工业常用磷精矿[Ca5(PO4)3F]和硫酸反应制各磷酸。己知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)F和硫酸反应制备磷酸的热化学方程式为________________。
(3)已知PCl5(g)![]() PCl3(g)+Cl2(g)△H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
PCl3(g)+Cl2(g)△H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
①PCl5的分解率a1=_____%。若达到兴衡后体系总压为1.4MPa,用平衡分压代替平衡浓度表示反应的平衡常数Kp=_________。
②温度为T2时,新的平衡体系中PCl5与Cl2分压相同,则PCl5的分解率a1________a2,温度T1___T2(填“>”“<”或“=”)。
③达到平衡后,下列情况使PCl5分解率增大的是___________(填字母)。
a.温度、体积不变,充入氩气 b.体积不变,对体系加热
C.温度、体积不变,充入氯气 d.温度不变,增大容器体积
(4)氧化水解法产三氯氧磷的废水中主要含有H3PO4、H3PO3等,可先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是__________________。
②下图是不同条件对磷的沉淀回收率的影响图像。处理该厂废水需控制的工艺条件为______。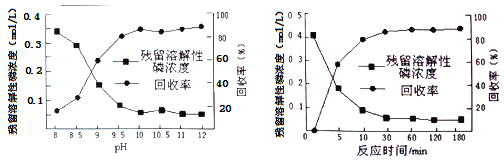
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com