
【题目】下列图示与对应的叙述不相符的是
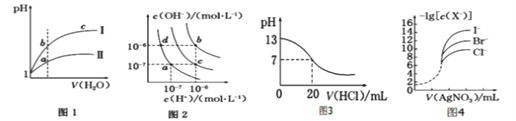
A. 图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强
B. 图2 中纯水仅升高温度,不能使a点变到c点
C. 图3 表示25 ℃时,用0.100 0 molL-1HCl 滴定20 mL 0.100 0 molL-1NaOH 溶液,溶液的pH随加入盐酸体积的变化
D. 用0.010 0 molL-1AgNO3标准溶液滴定浓度均为0.100 0 molL-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I-
【答案】C
【解析】A、醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,氯化氢是强电解质,完全电离,导致稀释过程中,醋酸中氢离子浓度大于盐酸,所以pH变化小的为醋酸,即II为醋酸,溶液的导电性与溶液中离子浓度成正比,a点导电能力大于b,故A正确;B、仅升温促进水的电离,氢氧根离子浓度增大,氢离子浓度和氢氧根离子浓度相同,与图像不相符合,故B正确;C、用0.1molL-1盐酸滴定20mL0.1molL-1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,与图像不符,故C错误;D、-lg[c(X-)]的值越大,代表该离子的浓度越小,由图可知,加入一定量的硝酸银后I-的浓度最小,则I-首先沉淀,故D正确;故选C。


科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
A.用CCl4提取溴水中的Br2[来 | B.从KI和I2的固体混合物中回收I2 | C.吸收NH3(极易溶于水),并防止倒吸 | D.工业酒精制备无水酒精 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO(g)+O2(g) =2CO2(g)反应的ΔH=—(2×283.0)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A的质谱图中,质荷比最大的数值为42。碳氢两元素的质量比为6:1,其核磁共振氢谱有三个峰,峰的面积比为1:2:3。A与其他有机物之间的关系如下:

已知:CH2=CH2![]() HOCH2CH2OH,回答下列问题:
HOCH2CH2OH,回答下列问题:
(1)有机物B的分子式___________________________。
(2)高聚物F结构简式为___________________。
(3)写出C与新制的氢氧化铜反应的化学方程式___________________________。
(4)E在一定条件下可以相互反应生成一种六元环有机物H,H的结构简式________.。
(5)写出生成G的化学方程式_____________________________________________;
【答案】 )C3H8O2 ![]()
![]()
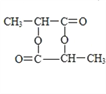 n
n![]()
![]()
![]() +(n-1)H2O
+(n-1)H2O
【解析】试题分析:本题考查有机推断,涉及有机物分子式和结构简式的确定、有机物分子式和结构简式的书写、有机反应方程式的书写。A的质谱图中质荷比最大的数值为42,A的相对分子质量为42,烃A中n(C):n(H)=![]() :
: ![]() =1:2,A的实验式为CH2,A的分子式为(CH2)x,14x=42,解得x=3,A的分子式为C3H6,A的核磁共振氢谱有三个峰且峰的面积比为1:2:3,A的结构简式为CH2=CHCH3。A发生加聚反应生成的高聚物F的结构简式为
=1:2,A的实验式为CH2,A的分子式为(CH2)x,14x=42,解得x=3,A的分子式为C3H6,A的核磁共振氢谱有三个峰且峰的面积比为1:2:3,A的结构简式为CH2=CHCH3。A发生加聚反应生成的高聚物F的结构简式为![]() ;A→B发生题给已知的反应,B的结构简式为
;A→B发生题给已知的反应,B的结构简式为![]() ;B→C发生醇的催化氧化,C的结构简式为
;B→C发生醇的催化氧化,C的结构简式为![]() ;C与Cu(OH)2加热时,C中-CHO被氧化,酸化后得到的D的结构简式为
;C与Cu(OH)2加热时,C中-CHO被氧化,酸化后得到的D的结构简式为![]() ;D与H2发生加成反应生成E,E的结构简式为
;D与H2发生加成反应生成E,E的结构简式为![]() ;E中含羟基和羧基,E发生缩聚反应生成高聚物G,G的结构简式为
;E中含羟基和羧基,E发生缩聚反应生成高聚物G,G的结构简式为![]() 。
。
(1)B的结构简式为![]() ,B的分子式为C3H8O2。
,B的分子式为C3H8O2。
(2)高聚物F的结构简式为![]() 。
。
(3)C的结构简式为![]() ,C与新制Cu(OH)2反应的化学方程式为
,C与新制Cu(OH)2反应的化学方程式为![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O。
+Cu2O↓+3H2O。
(4)E的结构简式为![]() ,2分子E通过酯化反应形成六元环有机物H,H的结构简式为
,2分子E通过酯化反应形成六元环有机物H,H的结构简式为 。
。
(5)G由E发生缩聚反应生成,生成G的化学方程式为n![]()
![]()
![]() +(n-1)H2O。
+(n-1)H2O。
【题型】推断题
【结束】
18
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知: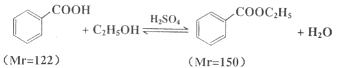
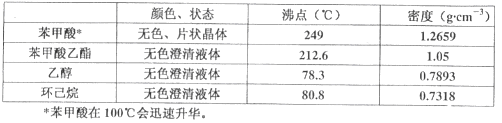

实验步骤如下:①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
(1)步骤①中使用分水器不断分离除去水的目的是_________________。
(2)步骤②中应控制馏分的温度在___________________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(3)步骤③中若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_____________。
(4)步骤④中分液操作叙述正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
蒸馏装置图中仪器A的名称是___________,在步骤④中加入氯化钙的作用是_________。
(5)该实验产品的产率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
(1)还原剂是________,还原产物__________。
(2)浓硝酸在反应中表现出来的性质是________________。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(3)当有9.6g铜参与反应时,在标准状况下,产生气体的体积为________,转移的电子数为___________。
(4)用双线桥法标出电子转移的方向和数目______。
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应并不改变的是( )
A.Na和O2
B.NaOH和CO2
C.Na2O2和CO2
D.木炭和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )

A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。
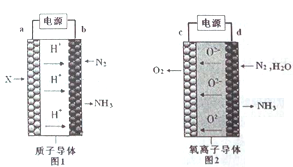
下列说法错误的是
A. a电极上通入的物质是H2
B. 电解池中b是阳极,c是阴极
C. d电极上电极反应式是N2+3H2O+6e-=2NH3+3O2-
D. 若I=2.0A,通电1h,理论上两装置均可得NH3的质量为![]() 。(已知一个电子的电量为1.6×10-19C)
。(已知一个电子的电量为1.6×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应2SO2+O2![]() 2SO3达到平衡时,v(O2)正=2v(SO3)逆
2SO3达到平衡时,v(O2)正=2v(SO3)逆
B. 用如图所示方法可保护钢闸门不被腐蚀

C. 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中![]() 的值增大
的值增大
D. 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com