
【题目】下列有关说法正确的是
A. 一定条件下反应2SO2+O2![]() 2SO3达到平衡时,v(O2)正=2v(SO3)逆
2SO3达到平衡时,v(O2)正=2v(SO3)逆
B. 用如图所示方法可保护钢闸门不被腐蚀

C. 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中![]() 的值增大
的值增大
D. 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
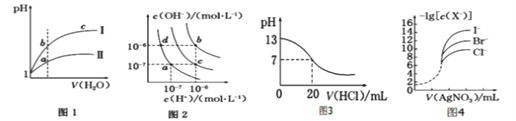
A. 图1表示同温度下,pH=1 的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线Ⅱ为醋酸,且a 点溶液的导电性比b 点强
B. 图2 中纯水仅升高温度,不能使a点变到c点
C. 图3 表示25 ℃时,用0.100 0 molL-1HCl 滴定20 mL 0.100 0 molL-1NaOH 溶液,溶液的pH随加入盐酸体积的变化
D. 用0.010 0 molL-1AgNO3标准溶液滴定浓度均为0.100 0 molL-1Cl-、Br-及I-的混合溶液,由图4 曲线,可确定首先沉淀的是I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含磷化合物在生产生活中有着重要的应用。
(1)磷与氨是同主族元素,下列能说明者非金属性强弱的是_______(填字母)。
a.NH3比PH3稳定性强
b.常温下,氮气为气体,磷单质为固体
c.氮气与氢气化合比磷与氢气化合更困难
d.HNO3的酸性比HPO3酸性强
(2)工业常用磷精矿[Ca5(PO4)3F]和硫酸反应制各磷酸。己知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)F和硫酸反应制备磷酸的热化学方程式为________________。
(3)已知PCl5(g)![]() PCl3(g)+Cl2(g)△H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
PCl3(g)+Cl2(g)△H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
①PCl5的分解率a1=_____%。若达到兴衡后体系总压为1.4MPa,用平衡分压代替平衡浓度表示反应的平衡常数Kp=_________。
②温度为T2时,新的平衡体系中PCl5与Cl2分压相同,则PCl5的分解率a1________a2,温度T1___T2(填“>”“<”或“=”)。
③达到平衡后,下列情况使PCl5分解率增大的是___________(填字母)。
a.温度、体积不变,充入氩气 b.体积不变,对体系加热
C.温度、体积不变,充入氯气 d.温度不变,增大容器体积
(4)氧化水解法产三氯氧磷的废水中主要含有H3PO4、H3PO3等,可先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是__________________。
②下图是不同条件对磷的沉淀回收率的影响图像。处理该厂废水需控制的工艺条件为______。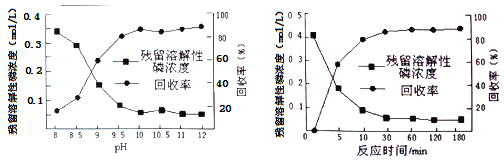
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必需的元素之一,海洋植物如海带、海藻中含有丰富的碘元素。沿海地区居民常食用海带,因此,甲状腺肿大等碘缺乏病发病率低。已知,碘元素以碘离子的形式存在,常温下I-能被氯水氧化为I2;I2在有机溶剂中的溶解度明显大于在水中的溶解度;I2有颜色,而I-无颜色。实验室里从海藻中提取碘的流程如图所示:
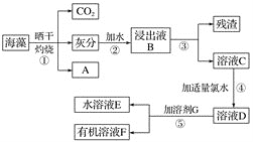
(1)写出A的化学式______________。
(2)步骤③操作所需要的玻璃仪器是______________、______________、__________________。
(3)下列有机溶剂中不可作为溶剂G的有________(填下面的序号)。
A.酒精 B.四氯化碳 C.乙酸 D.汽油 E.苯
(4)步骤⑤的操作名称是__________、分液;溶液E的颜色比溶液F的颜色______(填“深”或“浅”)。
(5)步骤⑤中,若选用(3)中的__________(填溶液名称)为溶剂G,分液时,应先把溶液____(填“E”或“F”)从分液漏斗的下部排出,之后,再把另一溶液从分液漏斗的上口倒出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验室制取蒸馏水的实验,回答下列问题:
(1)在试管中加入少量自来水,滴加几滴稀硝酸和几滴硝酸银溶液,观察到的实验现象是____________,由此说明自来水中含有的离子是__________________。
(2)实验室制取蒸馏水的装置如下图所示,请写出装置图中序号所示各仪器的名称____________。
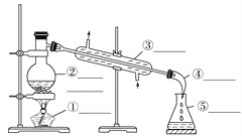
(3)若取仪器⑤中收集得到的液体少许,加入到试管中,然后滴加几滴稀硝酸和几滴硝酸银溶液,观察到的现象是____________,原因是________________________。
(4)通过上述实验,你认为蒸馏实验的应用是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的钙离子、镁离子、硫酸根离子及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为氯化钙)____________________________。
(3)若先用盐酸调溶液至中性,再过滤,将对实验结果产生影响,其原因是_________________________。
(4)判断氯化钡已过量的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A. 溶液A和B均可以是盐酸或氢氧化钠溶液
B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用氯化铁溶液,则实验难以实现
D. 实验方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )。
A.化学反应未必伴随能量变化
B.化学反应中的能量变化主要是由化学键变化引起的
C.化学反应中能量变化的大小与反应物的物质的量多少有关
D.有新物质生成是化学反应的根本特征
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为______________________________________。
(2)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是_____________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:__________________________________。
(3)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是_____________________________。
(4)右图所示原电池正极的反应式为___________________________。
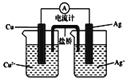
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com