
【题目】碘是人体必需的元素之一,海洋植物如海带、海藻中含有丰富的碘元素。沿海地区居民常食用海带,因此,甲状腺肿大等碘缺乏病发病率低。已知,碘元素以碘离子的形式存在,常温下I-能被氯水氧化为I2;I2在有机溶剂中的溶解度明显大于在水中的溶解度;I2有颜色,而I-无颜色。实验室里从海藻中提取碘的流程如图所示:
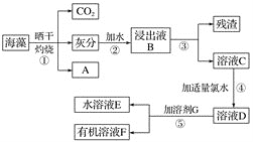
(1)写出A的化学式______________。
(2)步骤③操作所需要的玻璃仪器是______________、______________、__________________。
(3)下列有机溶剂中不可作为溶剂G的有________(填下面的序号)。
A.酒精 B.四氯化碳 C.乙酸 D.汽油 E.苯
(4)步骤⑤的操作名称是__________、分液;溶液E的颜色比溶液F的颜色______(填“深”或“浅”)。
(5)步骤⑤中,若选用(3)中的__________(填溶液名称)为溶剂G,分液时,应先把溶液____(填“E”或“F”)从分液漏斗的下部排出,之后,再把另一溶液从分液漏斗的上口倒出。
【答案】H2O 漏斗 烧杯 玻璃棒 AC 萃取 浅 四氯化碳 F
【解析】
(1)海藻晒干灼烧会产生水蒸气;
(2)从溶液中分离出残渣需要过滤,据此分析所需要的仪器;
(3)根据萃取剂的条件分析,即和原溶液中的溶剂互不相溶更不能发生化学反应,溶质在该溶剂中溶解度要远大于原溶剂;
(4)根据碘易溶在有机溶剂中分析;
(5)根据萃取剂的密度以及实验操作分析。
(1)海藻晒干灼烧会除产生二氧化碳和灰分以外,还应该有水蒸气生成,则A的化学式为H2O;
(2)步骤③是将溶液和不溶性固体分离出来,其操作是过滤,所需要的玻璃仪器是漏斗、烧杯、玻璃棒;
(3)A.酒精与水互溶,不能用于萃取碘水中的单质碘;
B.单质碘易溶在四氯化碳中,四氯化碳可以作萃取剂;
C.乙酸与水互溶,不能用于萃取碘水中的单质碘;
D.单质碘易溶在汽油中,汽油可以作萃取剂;
E.单质碘易溶在苯中,苯可以作萃取剂;
答案选AC。
(4)碘易溶在有机溶剂中,因此步骤⑤的操作名称是萃取、分液;由于碘从水层进入有机层,所以溶液E的颜色比溶液F的颜色浅。
(5)步骤⑤中,若选用(3)中的四氯化碳为溶剂G,由于四氯化碳的密度大于水,则分液时,应先把溶液F从分液漏斗的下部排出,之后,再把另一溶液从分液漏斗的上口倒出。如果选用(3)中的苯或汽油为溶剂G,由于苯或汽油的密度小于水,则分液时,应先把溶液E从分液漏斗的下部排出,之后,再把另一溶液从分液漏斗的上口倒出。


科目:高中化学 来源: 题型:
【题目】烃A的质谱图中,质荷比最大的数值为42。碳氢两元素的质量比为6:1,其核磁共振氢谱有三个峰,峰的面积比为1:2:3。A与其他有机物之间的关系如下:

已知:CH2=CH2![]() HOCH2CH2OH,回答下列问题:
HOCH2CH2OH,回答下列问题:
(1)有机物B的分子式___________________________。
(2)高聚物F结构简式为___________________。
(3)写出C与新制的氢氧化铜反应的化学方程式___________________________。
(4)E在一定条件下可以相互反应生成一种六元环有机物H,H的结构简式________.。
(5)写出生成G的化学方程式_____________________________________________;
【答案】 )C3H8O2 ![]()
![]()
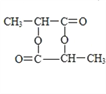 n
n![]()
![]()
![]() +(n-1)H2O
+(n-1)H2O
【解析】试题分析:本题考查有机推断,涉及有机物分子式和结构简式的确定、有机物分子式和结构简式的书写、有机反应方程式的书写。A的质谱图中质荷比最大的数值为42,A的相对分子质量为42,烃A中n(C):n(H)=![]() :
: ![]() =1:2,A的实验式为CH2,A的分子式为(CH2)x,14x=42,解得x=3,A的分子式为C3H6,A的核磁共振氢谱有三个峰且峰的面积比为1:2:3,A的结构简式为CH2=CHCH3。A发生加聚反应生成的高聚物F的结构简式为
=1:2,A的实验式为CH2,A的分子式为(CH2)x,14x=42,解得x=3,A的分子式为C3H6,A的核磁共振氢谱有三个峰且峰的面积比为1:2:3,A的结构简式为CH2=CHCH3。A发生加聚反应生成的高聚物F的结构简式为![]() ;A→B发生题给已知的反应,B的结构简式为
;A→B发生题给已知的反应,B的结构简式为![]() ;B→C发生醇的催化氧化,C的结构简式为
;B→C发生醇的催化氧化,C的结构简式为![]() ;C与Cu(OH)2加热时,C中-CHO被氧化,酸化后得到的D的结构简式为
;C与Cu(OH)2加热时,C中-CHO被氧化,酸化后得到的D的结构简式为![]() ;D与H2发生加成反应生成E,E的结构简式为
;D与H2发生加成反应生成E,E的结构简式为![]() ;E中含羟基和羧基,E发生缩聚反应生成高聚物G,G的结构简式为
;E中含羟基和羧基,E发生缩聚反应生成高聚物G,G的结构简式为![]() 。
。
(1)B的结构简式为![]() ,B的分子式为C3H8O2。
,B的分子式为C3H8O2。
(2)高聚物F的结构简式为![]() 。
。
(3)C的结构简式为![]() ,C与新制Cu(OH)2反应的化学方程式为
,C与新制Cu(OH)2反应的化学方程式为![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +Cu2O↓+3H2O。
+Cu2O↓+3H2O。
(4)E的结构简式为![]() ,2分子E通过酯化反应形成六元环有机物H,H的结构简式为
,2分子E通过酯化反应形成六元环有机物H,H的结构简式为 。
。
(5)G由E发生缩聚反应生成,生成G的化学方程式为n![]()
![]()
![]() +(n-1)H2O。
+(n-1)H2O。
【题型】推断题
【结束】
18
【题目】苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:
已知: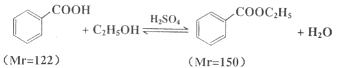
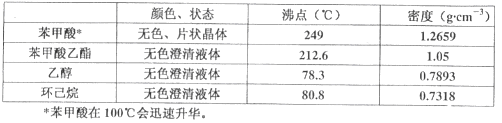

实验步骤如下:①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
(1)步骤①中使用分水器不断分离除去水的目的是_________________。
(2)步骤②中应控制馏分的温度在___________________。
A.65~70℃ B.78~80℃ C.85~90℃ D.215~220℃
(3)步骤③中若Na2CO3加入不足,在步骤④蒸馏时,蒸馏烧瓶中可见到白烟生成,产生该现象的原因是_____________。
(4)步骤④中分液操作叙述正确的是__________。
A.水溶液中加入乙醚,转移至分液漏斗中,塞上玻璃塞。将分液漏斗倒转用力振摇
B.振摇几次后需打开分液漏斗下口的玻璃塞放气
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出
蒸馏装置图中仪器A的名称是___________,在步骤④中加入氯化钙的作用是_________。
(5)该实验产品的产率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。
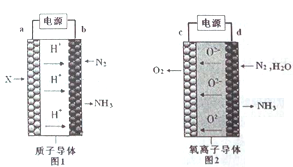
下列说法错误的是
A. a电极上通入的物质是H2
B. 电解池中b是阳极,c是阴极
C. d电极上电极反应式是N2+3H2O+6e-=2NH3+3O2-
D. 若I=2.0A,通电1h,理论上两装置均可得NH3的质量为![]() 。(已知一个电子的电量为1.6×10-19C)
。(已知一个电子的电量为1.6×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是由苯乙烯为原料合成有机高分子化合物M的一种合成路线(部分反应条件及副产物已略去):

已知:I.RCHBr-CH2Br![]() RC≡CH
RC≡CH
II.CH≡CH+CH2=CH-CH=CH2![]()
III. 
请回答下列问题:
(1)D的结构简式为______,E的结构简式为________。
(2)C+D→E的反应类型为______,I中含氧官能团的名称为___________。
(3)H+I→M的化学方程式为___________。
(4)在催化剂加热条件下,G与氧气反应生成Q(C9H8O3),同时满足下列条件的Q的同分异构体有_____种(不考虑立体异构),其中核磁共振氢谱有6组吸收峰的结构简式为____。
①除苯环外不含其他环状结构
②能与FeCl3溶液发生显色反应
③能与NaHCO3溶液反应生成CO2
(5)参照上述合成路线和相关信息,以甲醇和一氯环己烷为有机原料(无机试剂任选),设计制备己二酸二甲酯的合成路线_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO47H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是:__________(填字母序号)。
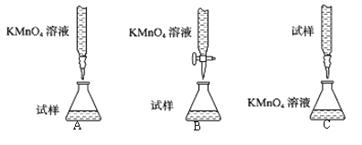
②该小组拟在同浓度的FeSO4溶液中,探究酸性KMnO4溶液浓度对Fe2+被氧化时反应速率的影响。限选试剂与仪器:0.10molL-1FeSO4、0.02molL-1酸性KMnO4、蒸馏水、锥形瓶、试管、胶头滴管、量筒、秒表。参照下表格式,完成实验表格(列出所选试剂体积和数据;数据用字母表示)。_____________、_____________、_____________、_____________。

(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图所示。
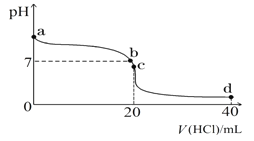
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=__________________。
②取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释:___________________________________。
③d点所示溶液中离子浓度由大到小的排序是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 一定条件下反应2SO2+O2![]() 2SO3达到平衡时,v(O2)正=2v(SO3)逆
2SO3达到平衡时,v(O2)正=2v(SO3)逆
B. 用如图所示方法可保护钢闸门不被腐蚀

C. 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中![]() 的值增大
的值增大
D. 常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式书写正确的是( )
A. 高温下铁与水蒸气反应生成保护膜:2Fe+6H2O(g)=2Fe(OH)3+3H2
B. 稀硫酸与氢氧化钡溶液混合:SO42—+Ba2+=BaSO4↓
C. 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
D. 盐酸与澄清石灰水反应:H++OH-=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应物的总能量高于生成物时,该反应为______________反应;当反应物的总能量低于生成物时,该反应为______________反应(填“吸热或放热”),能量越高的物质越______________(填“稳定或不稳定”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com