
| A. | 石灰水和碳酸钠 | B. | 偏铝酸钠和盐酸 | ||
| C. | 石灰水和磷酸 | D. | 硫酸铝和氢氧化钠 |
分析 不用试剂无法鉴别,则改变物质的用量,发生的反应及现象相同;结合物质的颜色及改变用量发生的反应来鉴别物质,以此来解答.
解答 解;A.二者混合只生成碳酸钙沉淀,不加其它试剂不能鉴别,故A选;
B.HCl少量生成沉淀,HCl过量沉淀溶解,不需要试剂可鉴别,故B不选;
C.石灰水滴加到磷酸中,开始生成磷酸氢钙,没有沉淀,氢氧化钙过量时生成磷酸钙沉淀,磷酸加入到石灰水中马上生成磷酸钙沉淀,现象不同,故B不选;
D.将硫酸铝溶液滴加到氢氧化钠溶液中,先无沉淀生成,当硫酸铝滴加到一定程度时才有沉淀,但把氢氧化钠溶液滴加到硫酸铝溶液中,立即产生沉淀,当氢氧化钠过量时沉淀溶解,滴加顺序不同,反应的现象不同,用其他试剂就可鉴别,故D不选.
故选A.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质及发生的反应为解答的关键,侧重与量有关的离子反应考查,题目难度不大.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:选择题
| A. | O2通入酸化的KI淀粉溶液中 | |
| B. | CO2通入CaCl2溶液中 | |
| C. | 0.1mol•L-l稀H2SO4滴入0.1 mol•L-1Na2S2O3溶液中 | |
| D. | 0.2mol•L-1H2C2O4溶液滴入酸化的KMnO4溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于漂白纸浆 | |
| B. | 硅酸钠溶液呈碱性,可用作木材防火剂 | |
| C. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| D. | H2O2具有还原性,可用于与酸性高锰酸钾溶液反应制取少量氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )
可逆反应A(?)+aB(g)?C(g)+D(g).反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示.下列说法不正确的是( )| A. | 若a=1,则A为液体或固体 | |
| B. | 该反应正反应为放热反应 | |
| C. | T2>T1,p2>p1 | |
| D. | 其他条件不变,增加B的物质的量,化学平衡向正反应方向移动,化学平衡常数K增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
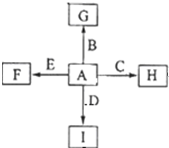 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com