
【题目】在 2Na + Cl2 ![]() 2NaCl反应中,
2NaCl反应中,
(1)还原剂是 _______,氧化剂是 ________;
(2)_____元素被氧化,______元素被还原。
(3)2 molNa参与反应电子转移的数目为________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】1mol白磷(P4,s)和4mol红磷(P,s)与氧气反应过程中的能量变化如图(E表示能量)。下列说法正确的是( )
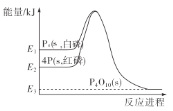
A. P4(s,白磷)=4P(s,红磷) ΔH>0
B. 以上变化中,白磷和红磷所需活化能相等
C. 白磷比红磷稳定
D. 红磷燃烧的热化学方程式是4P(s,红磷)+5O2(g)=P4O10(s) ΔH=-(E2-E3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知单质铜与稀硝酸的反应为3Cu+8HNO3=2NO↑+4H2O+3Cu(NO3)2(Cu的相对原子质量为64)。现把19.2 g Cu放入200 mL 5 mol·L-1硝酸中,充分反应,问:
(1)参加反应的硝酸的物质的量为多少?______________
(2)在标准状况下产生的气体的体积为多少?____________
(3生成水的分子数为多少?___________
(4)若反应前后溶液的体积不变,则生成Cu(NO3)2的物质的量浓度为多少?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(3)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________。
(4)HT是一种难溶于水的有机溶剂,则操作Ⅰ的名称为_________。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________________________________。
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+ (水层)+3HT(有机层) ![]() CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:___________________________________。
(7)已知,298K时,Ksp[Ce(OH)3]=5×l0-20,若溶液中c(Ce3+)=0.05mol·L-1,加碱调节pH到_________时Ce3+开始沉淀(忽略加碱过程中溶液体积变化)。
(8) 写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠及其重要化合物之间的转化关系如下图所示:

回答下列问题:
(1)少量的金属钠应保存在______中,过氧化钠是_____色粉末
(2)钠和水反应的方程式_________该反应氧化剂是_________。
(3)Na2CO3溶液与BaCl2溶液反应产生白色沉淀,其中Na2CO3参加反应的离子是_______(填“Na+”或“CO32-”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种短周期元素的原子序数依次增大,A 的一种核素在考古时常用来鉴定一些文物的年代,B的气态氢化物的水溶液呈碱性;C为金属元素且有两种常见含氧化合物(都含两种元素);若往D单质的水溶液中滴加少量紫色石蕊试液,可观察到先变红后褪色。下列说法中正确的是
A. C的两种含氧化合物中阴阳离子个数比都为1:2
B. 最高价氧化物对应的水化物的酸性B>D
C. B的氢化物的沸点一定高于A的氢化物
D. 原子半径D>A>B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S | K1=9.1×10-8K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,则此时溶液中c(OH-)为_______mol/L;此时温度__________25 ℃(填“大于”,“小于”或“等于”),若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为______mol/L。
(2)下列四种离子结合H+能力最强的是______。
A.HCO3- B. C2O42- C. S2- D.CH3COO-
(3)该温度下1.0 mol·L-1的CH3COOH溶液中的c(H+)=_____span> mol·L-1
(4)常温下,加水稀释0.1 mol·L-1的H2C2O4溶液,下列说法正确的是(______)
A.溶液中n(H+)×n(OH-)保持不变
B.溶液中水电离的c(H+)×c(OH-)保持不变
C.溶液中c(HC2O4-)/c(H2C2O4)保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示装置探究金属的腐蚀与防护,下列有关说法错误的是

A. 图①,放置于干燥空气中的铁钉不易生锈
B. 图②,用酒精灯加热具支试管,可以更快更清晰地观察到液柱上升
C. 图③,利用了外加电流的阴极保护法保护钢闸门不被腐蚀
D. 图④,利用了牺牲阳极的阴极保护法保护钢铁输水管不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.9 g D2O中含有的电子数为5NA
B.46 g NO2和N2O4混合气体中含有原子数为3NA
C.1 mol C2H6分子中含共价键总数为6NA
D.7.1 g C12与足量NaOH溶液反应,转移的电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com