
| A. | HCl和H2O | B. | O2和H2O | C. | NH3和H2O | D. | CO2和NaOH溶液 |
分析 由题意:喷泉产生原因是存在压强差;当气体能与液体反应或极易溶于液体时,造成烧瓶内部压强变小,导致烧瓶内外产生压强差而形成喷泉.
解答 解:A、氯化氢气体极易溶于水,使瓶内气压减小,能产生喷泉现象,故A不符合;
B、氧气不易溶于水,使瓶内气压变化不大,不能产生喷泉现象,故B符合;
C、氨气易溶于水,使瓶内气压减小,能产生喷泉现象,故C不符合;
D、二氧化碳能与氢氧化钠溶液反应生成碳酸钠与水,使瓶内气压减小,故能形成喷泉,故D不符合.
故选B.
点评 本题难度中等,根据题中形成喷泉的信息来考查学生对于常见的化学反应、气体的溶解性的认识,考查同学们灵活运用所学化学知识进行解题的能力,题目难度不大.


科目:高中化学 来源: 题型:解答题
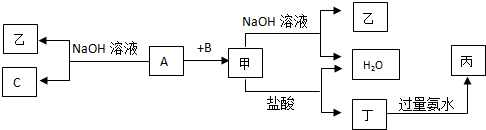
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、NO3-、Na+、Cl- | B. | Mg2+、Na+、CH3COO-、Cl- | ||
| C. | SO42-、HCO3-、K+、Na+ | D. | Ba2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
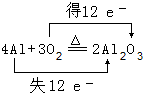
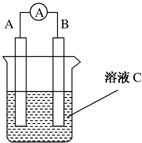
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
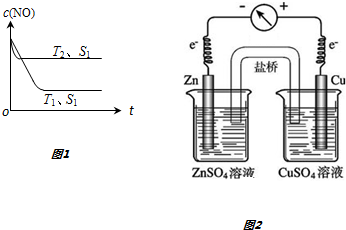
 如图所示是原电池的装置图(
如图所示是原电池的装置图( 为电流表).请回答:
为电流表).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
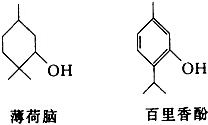 下列物质是几种常见香精的主要成分:
下列物质是几种常见香精的主要成分: .
.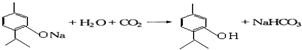 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com