
����Ŀ���ߴ�MnCO3���Ʊ������ܴ��Բ��ϵ���Ҫԭ�ϡ�ʵ������MnO2Ϊԭ���Ʊ������ߴ�MnCO3�IJ����������£�
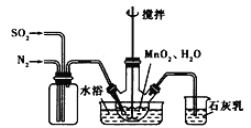
��1���Ʊ�MnSO4��Һ������ƿ����װ�ü���ͼ������һ����MnO2��ˮ�����裬ͨ��SO2��N2������壬��Ӧ3h��ֹͣͨ��SO2��������ӦƬ�̣����ˡ�
��д����Ӧ����ʽ��MnO2+ H2SO3=_________________��
ʯ������뷴Ӧ�Ļ�ѧ����ʽΪ___________________��
�ڷ�Ӧ�����У�ΪʹSO2������ת����ȫ����ͨ��SO2��N2����һ�������ı��ҺͶ�ϵ������£��ɲ�ȡ�ĺ�����ʩ������������________________��___________________��

����ʵ���н�N2���ɿ�������÷�ӦҺ��Mn2+��SO42-��Ũ���淴Ӧʱ��t�仯����ͼ��������Һ��Mn2+��SO42-��Ũ�ȱ仯�������Բ���������Mn2+��O2��H2SO3��Ӧ�����������_________________��
��2���Ʊ��ߴ�MnCO3���壺��֪MnCO3������ˮ���Ҵ�����ʪʱ�ױ�����������100�濪ʼ�ֽ⣻Mn��OH��2��ʼ������pH= 7��7��
�벹������1���Ƶõ�MnSO4��Һ�Ʊ��ߴ�MnCO3�IJ�������[ʵ���п�ѡ�õ��Լ���H2O ��Ca��OH��2��NaHCO3��Na2CO3��C2H5OH]��
���߽������_________________����������ҺpH_______7��7��
��_______________________��
��_______________________��
��_______________________��
�ݵ���100����
���𰸡���1����MnO2��H2SO3��MnSO4��H2O SO2��Ca��OH��2��CaSO3��H2O���ڿ����ʵ����¶� ������ͨ�������壻��Mn2�� �������������ᷴӦ�������ᡣ��2����̼���ƻ�̼�����ơ������ڹ��ˣ�������ˮϴ��2-3�� �ۼ���SO42���Ƿ�ȥ �����������Ҵ�ϴ��
��������
�����������1���ٶ������̺������ᷢ��������ԭ��Ӧ���������̺�ˮ����ѧ����ʽΪMnO2+ H2SO3= MnSO4��H2O ��ʯ��������������ն���Ķ��������߷�Ӧ����������ƺ�ˮ����ѧ����ʽΪSO2��Ca��OH��2��CaSO3��H2O ���� ��Ӧ�����У�ΪʹSO2������ת����ȫ����ͨ��SO2��N2����һ�������ı��ҺͶ�ϵ������£��ɲ�ȡ�ĺ�����ʩ�п����ʵ����¶� ������ͨ�������塣�۵�����Һ��Mn2+��SO42-��Ũ�ȱ仯�������Բ��죬����Mn2+��O2��H2SO3��Ӧ�����������Mn2�� �������������ᷴӦ�������ᡣ
��2�����������Ϣ��MnCO3������ˮ���Ҵ�����ʪʱ�ױ�����������100�濪ʼ�ֽ⣻Mn��OH��2��ʼ������pH= 7��7��ʵ���п�ѡ�õ��Լ���H2O ��Ca��OH��2��NaHCO3��Na2CO3��C2H5OHȷ����MnSO4��Һ�Ʊ��ߴ�MnCO3�IJ�������Ϊ�ٱ߽������̼���ƻ�̼����������������ҺpHС��7��7�������ˣ�������ˮϴ��2-3����������SO42���Ƿ�ȥ�������������Ҵ�ϴ�����ݵ���100����


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NH4I���ܱ����������ȷֽⷢ�����з�Ӧ��NH4I��s��![]() NH3��g��+HI��g����2HI��g��
NH3��g��+HI��g����2HI��g��![]() H2��g��+I2��g���ﵽƽ��ʱ��c��HI��=4mol/L��c��I2��=0��5 mol/L������˵����ȷ����
H2��g��+I2��g���ﵽƽ��ʱ��c��HI��=4mol/L��c��I2��=0��5 mol/L������˵����ȷ����
A��ƽ��ʱHI�ķֽ���20%
B����Ӧ��ʼʱ����NH4I��5 mol
C��ƽ��ʱ��c ��NH3��=4��5mol/L
D��ƽ��ʱHI�ķֽ���10%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na��Mg��Al��0.4mol�ֱ����100mL��2mol/L�������У�ͬ��ͬѹ�²����������������ǣ�
A��1:1:1 B��2:1:1 C��3��1��1 D��1:2:3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ĿǰΪֹ���ɻ�ѧ��ת������ܻ������Ȼ������ʹ�õ�����Ҫ����Դ��
(1)��25����101kPa�£�16g�ļ״�(CH3OH)��ȫȼ������CO2��Һ̬ˮʱ�ų�352kJ�����������ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪ_____________________��
(2)��ѧ��Ӧ�зų�������(�ʱ䣬��H)�뷴Ӧ���������ļ���(E)�йأ�
��֪��H2(g)+Cl2(g)=2HCl(g)��H=��185kJ/mol��
E(H��H)=436kJ/mol��E(Cl��Cl)=243kJ/mol��E(H��Cl)=_____________
(3)����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע����֪��
2Cu(s)+![]() O2(g)�TCu2O(s)��H=��169kJmol��1��
O2(g)�TCu2O(s)��H=��169kJmol��1��
C(s)+![]() O2(g)�TCO(g)��H=��110.5kJmol��1��
O2(g)�TCO(g)��H=��110.5kJmol��1��
2Cu(s)+O2(g)�T2CuO(s)��H=��314kJmol��1
��ҵ����̿���ڸ��������»�ԭCuO��ȡCu2O��CO���Ȼ�ѧ����ʽ_____________��
(4)��ͼ��N2��H2��Ӧ����2molNH3�����������仯ʾ��ͼ��

�������ÿ����1molNH3�ų�����Ϊ��_________��
������ʼʱ�������ڷ���1molN2��3molH2��ƽ���N2��Ϊ20%����Ӧ�ų�������ΪQ1kJ����Q1����ֵΪ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܶ�Ϊ0.911g/cm3�İ�ˮ����Һ�����ʵ���������Ϊ25%���ð�ˮ�õ������ˮϡ�ͺ�������Һ��������Ϊ( )
A������12.5% B������12.5% C��С��12.5% D����ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦaA��g����bB��s��![]() cC��g���У����ʵĺ���A%��C%���¶��ı仯������ͼ��ʾ������˵����ȷ����
cC��g���У����ʵĺ���A%��C%���¶��ı仯������ͼ��ʾ������˵����ȷ����
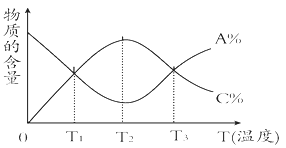
A���÷�Ӧ��T1��T3�¶�ʱ�ﵽ����ѧƽ��
B���÷�Ӧ���淴Ӧ�Ƿ��ȷ�Ӧ
C���÷�Ӧ��T2�¶�ʱ�ﵽ����ѧƽ��
D������������ƽ���������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����ȷ���� �� ��
A. Խ����ֲ����������ˮ����ˮ�ı�ֵ�½��������ڵֿ������Ļ�������
B. �����Ǵ����Ŵ���Ϣ�����Ƶ����ʺϳɵ���������
C. ���ۡ���ԭ����ά�غͺ��Ƕ�����������
D. ���ǡ������ʡ����������̼��Ϊ�Ǽܵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϸ���л��������ҪԪ��ռϸ�����صĺ������ɶൽ����ȷ�������ǣ� ��
A. ˮ�������ʡ�֬�ʡ����� O��C��H��N
B. ˮ�������ʡ����ࡢ֬�� C��O��H��N
C. ˮ�����ࡢ�����ʡ�֬�� O��C��H��N
D. ˮ��֬�ʡ������ʡ����� O��N��C��H
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ѫ�쵰���к���Fe2�����ӣ���ʳ�������Σ���ʹ���ж�����Ϊ�������λ�ʹFe2������ת���Fe3�����ӣ����ɸ���Ѫ�쵰��ɥʧ��O2��ϵ�����������ά����C�ɻ������������ж�����˵��ά����C����
A������
B������
C��������
D����ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com