
【题目】将Na、Mg、Al各0.4mol分别放入100mL、2mol/L的盐酸中,同温同压下产生的气体的体积比是:
A.1:1:1 B.2:1:1 C.3:1:1 D.1:2:3
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】组成细胞和生物体的化学元素中,最基本元素、主要元素、大量元素分别是
①C ②C、H、0、N ③C、H、0、N、P、S ④C、H、0、N、P、S、K、Ca、Mg
A. ②③④ B. ①②④ C. ①③④ D. ②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说认正确的是
A. 丙烯和聚丙烯的组成和性质相同
B. 乙酸制乙酸甲酯属于加成反应
C. 苯和环己烷的二氯代物都有3种
D. 乙醇浸泡中草药时作溶剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅的化学性质的叙述,正确的是( )
A.常温时不和任何酸反应 B.常温时可和强碱溶液反应
C.单质硅比碳的还原性强 D.单质硅比碳的氧化性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.增大压强,化学反应速率增加
B.降低压强,化学反应速率降低
C.改变压强,化学反应速率可能不变
D.改变压强引起了速率改变,平衡就会移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1mol/LCH3COOH溶液的电离平衡的叙述正确的是
A.加水稀释,Ka不会改变
B.加入少量醋酸钠晶体,电离程度增大
C.加水稀释,溶液中粒子浓度都减小
D.升高温度,溶液中粒子浓度都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用相对应的是( )
A.NH3极易溶于水,可用作制冷剂
B.Al2O3熔点高,可用作耐高温材料
C.SO2具有氧化性,可用于漂白品红、织物等
D.BaCO3能与盐酸反应,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3是制备高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
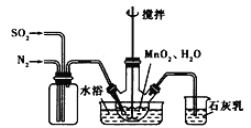
(1)制备MnSO4溶液:在烧瓶中(装置见上图)加入一定量MnO2和水,搅拌,通人SO2和N2混合气体,反应3h。停止通入SO2,继续反应片刻,过滤。
①写出反应方程式:MnO2+ H2SO3=_________________;
石灰乳参与反应的化学方程式为___________________。
②反应过程中,为使SO2尽可能转化完全,在通人SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有(填两种)________________、___________________。

③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如上图。导致溶液中Mn2+、SO42-的浓度变化产生明显差异,其中Mn2+对O2与H2SO3反应所起的作用是_________________。
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀的pH= 7.7。
请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:H2O 、Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]。
①边搅拌边加入_________________,并控制溶液pH_______7.7;
②_______________________;
③_______________________;
④_______________________;
⑤低于100℃干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com