
【题目】下列反应的离子反应方程式正确的是:( )
A. 过量的二氧化碳通入NaOH溶液中:CO2+OH-==HCO3-
B. 氯气通入水中:Cl2+H2O==Cl-+ClO- +2H+
C. 硫酸亚铁溶液加入过氧化氢溶液Fe2++2H2O2+4H+==Fe3++4H2O
D. 向AlCl3溶液中过量的氨水:Al3+十4NH3·H2O==AlO2-十4NH4+十2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】等浓度的下列稀溶液:①乙酸Ka:1.76×10—5、②HClO Ka:2.95×10—8、③碳酸Ka1:4.30×10—7、④乙醇,它们的pH由小到大排列正确的是( )
A. ④②③①B. ③①②④C. ①②③④D. ①③②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中所列①~⑩元素,填写下列空白。

(1)单质性质最不活泼的元素是(填元素符号)_____。
(2)地壳中含量最多的元素在元素周期表中的位置为第_____周期_____族。
(3)元素①的气态氢化物中含有的化学键的类型为__________。
(4)第三周期元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)____________,具有两性的是_____________。
(5)元素⑦的氧化物与氢氧化钠溶液反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成 ![]() 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答

(1)写出鉴别苯酚与A这2种有机物的方法,用必要的文字说明: .
(2)写出以下物质的结构简式:B ,F .
(3)写出反应④的化学反应方程式:④ ,
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中正确的是 ( )
A. 在同一个电子层上运动的电子,其自旋方向肯定不同
B. 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
C. 物质的键能越大,该物质本身具有的能量越低
D. 在周期表中原子的族序数等于它的最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、A、B、D、N、E六种短周期元素,原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
![]()
A.A、B、D、E四种元素分别与M元素形成的简单化合物中,稳定性最强的是H2O
B.M、D、E、N形成的简单离子的半径大小:S2>O2>Na+>H+
C.A、B、D、M可组成多种含18电子的分子,如CH3OH、CH3CH3、CH3NH2等
D.B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各组物质性质的比较中,正确的是
A. 硬度:Li>Na>K
B. 熔点:NaCl>CaO
C. 电负性:Na<Al<Mg
D. 空间利用率:体心立方堆积<六方堆积<面心立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=179.38 kJ·mol1
已知: 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=159.47 kJ·mol1
NH2CO2NH4(s) ===CO(NH2)2(s)+H2O(l) ΔH=+72.49 kJ·mol1
则N2(g)+3H2(g) ===2NH3(g) ΔH= kJ·mol1。
(2)储氢材料领域是当前研究热点,LiBH4是一种良好的储氢材料。采用球磨法制备Al与LiBH4的复合材料,并对AlLiBH4体系与水反应产氢的特性进行下列研究:
①图甲为25℃水浴时每克不同配比的AlLiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的 (填字母)。
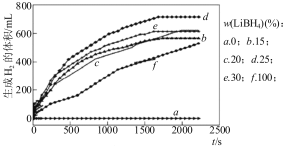

甲 乙
a.25℃时,纯LiBH4和铝均与水反应产生氢气
b.25℃时,复合材料中铝不能产生氢气,只是起到催化作用
c.25℃时,AlLiBH4复合材料中LiBH4含量25%,储氢效果最好
②图乙为25℃和75℃时,AlLiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X射线衍射图谱(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。从图分析,25℃时AlLiBH4复合材料中LiBH4与水反应生成的LiB(OH)4化学方程式为 ,铝元素的存在有多种形式,其中Al(OH)3产生的原因可能是 。
(3)已知H2S高温热分解制H2的反应为:H2S(g)![]() H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:
H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:

图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(S2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(4)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l) ===CO2(g)+2H2(g)现将一定量的1 mol·L1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL1~0.12g·mL1的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。则B极的电极反应式为 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com