
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
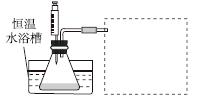
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2溶液、0.1 mol·L-1Fe2(SO4)3溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:______________________________。
②设计实验方案:在不同H2O2浓度下,测定________(要求所测得的数据能直接体现反应速率大小)。
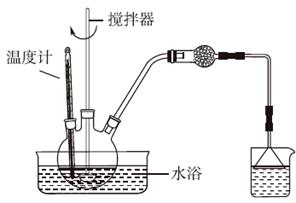
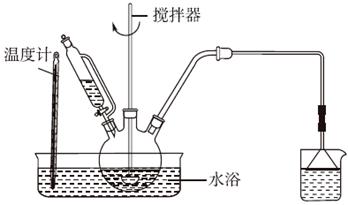
③设计实验装置,完成图中的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
(2)利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的__________(填“深”或“浅”),其原因是____________________________。
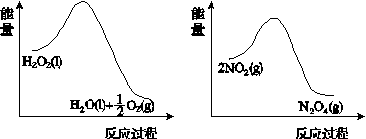
(a) (b)
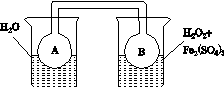
(c)
图21
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
下列说法中不正确的是
A.处于最低能量的原子叫做基态原子 B.4f 4表示4f能级有四个轨道
C.同一原子中,2p、3d、4f能级的轨道数依次增多
D.同一原子中,2p、3p、4p电子的能量逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O―→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7+CaCO3―→Ca(C6H12O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的 溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的 溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
实验流程如下:
C6H12O6溶液

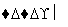
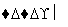 悬浊液
悬浊液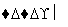
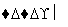
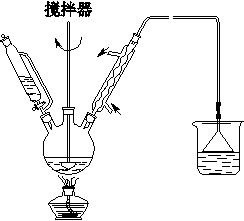
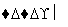 Ca(C6H12O7)2
Ca(C6H12O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置中最适合的是________。
A
B
C
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液
B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶
D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是_____________________________;本实验中不宜用CaCl2替代CaCO3,理由是______________________________。
(3)第③步需趁热过滤,其原因是______________________________________________。
(4)第④步加入乙醇的作用是_________________________________________________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水
B.热水
C.乙醇
D.乙醇水混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):
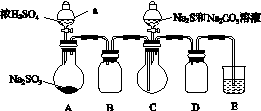
实验步骤:
(1)检查装置气密性,如图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是______________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaO(s) + SO2(g) + CO2(g) ΔH1=218.4 kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
CaS(s) + 4CO2(g) ΔH2=-175.6 kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)反应Ⅰ能够自发进行的反应条件是________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量的浓度c(B),则反应Ⅱ的Kp=________(用表达式表示)。
(3)假设某温度下,反应Ⅰ的速率(v1 )大于反应Ⅱ的速率(v2 ),则下列反应过程能量变化示意图正确的是________。
(4)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是____________________________________________________________________。
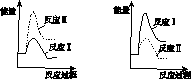
A B
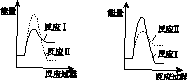
C D
(5)图(a)为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有________。
A.向该反应体系中投入石灰石
B.在合适的温度区间控制较低的反应温度
C.提高CO的初始体积百分数
D.提高反应体系的温度
(6)恒温恒容条件下,假设反应Ⅰ和Ⅱ同时发生,且v1>v2,请在图(b)画出反应体系中c(SO2)随时间t变化的总趋势图。
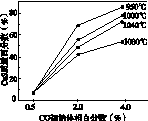
(a) (b)
查看答案和解析>>
科目:高中化学 来源: 题型:
将钠、镁各O.2 m01分别放入100 mL 1 mol/l的盐酸中, 同温同压下产生的气体体积之比是 ( )
A.1:2 B.1:3 C.2:1 D.1:l
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生
成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可
以采取的措施是_____(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均
为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度
(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 | 温度 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,
可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com