
工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生
成二氧化碳,其三步反应如下:
① 2H2 (g)+CO(g)  CH3OH (g) ΔH= -90.8 kJ·mol-1
CH3OH (g) ΔH= -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+H2O(g)  CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
CO2 (g)+H2(g) ΔH= -41.3 kJ·mol-1
(1)总合成反应的热化学方程式为 。
(2)一定条件下的密闭容器中,上述总反应达到平衡时,要提高CO的转化率,可
以采取的措施是_____(填字母代号)。
A.高温高压 B.加入催化剂 C.减少CO2的浓度
D.增加CO的浓度 E.分离出二甲醚
(3)反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均
CH3OCH3(g)+H2O(g)在四种不同条件下进行(反应器均
为相同的恒容密闭容器,CH3OCH3、H2O起始浓度为0),CH3OH(g)的浓度
(mol/L)随反应时间(min)的变化情况如下表:
| 实验 序号 | 温度 浓度 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
①实验1,反应在10至20分钟时间内用CH3OH(g)表示的平均速率为 。
②实验2,CH3OH(g)的初始浓度c2= mol/L,反应经20分钟就达到平衡,
可推测实验2中还隐含的条件是 。
③设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3= mol/L。
科目:高中化学 来源: 题型:
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
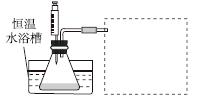
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2溶液、0.1 mol·L-1Fe2(SO4)3溶液、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:______________________________。
②设计实验方案:在不同H2O2浓度下,测定________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成图中的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
| 物理量 实验序号 | V[0.1 mol·L-1 Fe2(SO4)3]/mL | …… | |
| 1 | a | …… | |
| 2 | a | …… |
(2)利用图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的__________(填“深”或“浅”),其原因是____________________________。
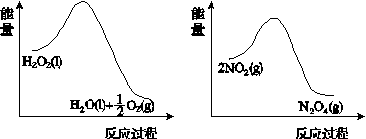
(a) (b)
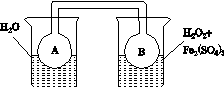
(c)
图21
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应的描述中正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1) △H=-57.3 kJ·mol-1,
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为
2CO(g)+O2(g)=2CO2(g) △H=-283.0 kJ·mol-1
D.已知2C(s) +2O2(g)=2CO2(g) △H=a,2C(s) +O2(g)=2CO(g) △H=b,则b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
右图表示溶液中c(OH-)和c(H+)的关系,下列判断错误的是( )
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
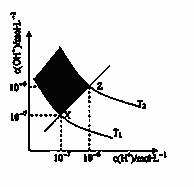
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)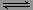 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下
表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.该温度下此反应的平衡常数K=1.44
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )。
A.液态氯化氢、固体氯化钾均不导电,故HCl和KCl均为非电解质
B.NH3、SO3水溶液都能导电,故二者均为电解质
C.铜和石墨均能导电,所以它们都是电解质
D.蔗糖、乙醇在水溶液和熔化状态都不导电,所以它们是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化铈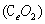 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含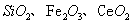 以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
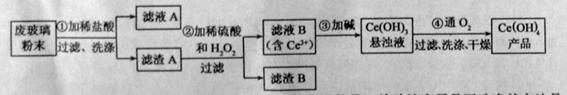
(1)洗涤滤渣A的目的是为了去除 (填离子符号),检验该离子是否洗涤的方法是 。
(2)第②步反应的离子方程式是 ,滤渣B的主要成分是 。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP (填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有 、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的
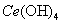 产品0.536g,加硫酸溶解后,用0.1000mol•
产品0.536g,加硫酸溶解后,用0.1000mol•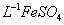 标准溶液滴定终点是(铈被还原为
标准溶液滴定终点是(铈被还原为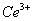 ),消耗25.00mL标准溶液,该产品中
),消耗25.00mL标准溶液,该产品中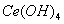 的质量分数为 。
的质量分数为 。
27.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com