12.I.及其化合物在工农业生产中应用广泛.硼镁矿主要成分为Mg
2B
2O
5•H
2O.利用硼镁矿制取金属镁及粗硼的工艺流程为(部分步骤已省略):
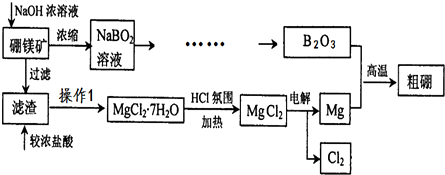
回答下列有关问题:
(1)图中操作1的步骤为蒸发浓缩、蒸发浓缩、降温结晶、洗涤、低温干燥;
(2)MgCl
2•7H
2O需要在HCl氛围中加热,其目的是防止MgCl
2水解生成Mg(OH)
2.
(3)制得的粗硼可以在一定条件下生成BI
3,BI
3加热分解可以得到纯净的单质硼.现将0.2000g粗硼制成的BI
3完全分解,将生成的I
2配制成100mL溶液,用酸式滴定管(填“酸式”或“碱式”)量取10mL碘水溶液放入锥形瓶中,向其中滴加几滴淀粉溶液,用0.3000mol•L
-1 Na
2S
2O
3溶液滴定至终点,如何判断滴定终点:滴加最后一滴Na
2S
2O
3溶液,锥形瓶中蓝色恰好褪去,且半分钟不恢复原色;滴定至终点时,消耗Na
2S
2O
3溶液18.00mL,则该粗硼样品的纯度为99%(提示:I
2+2S
2O
32-═2I
-+S
4O
62-).
Ⅱ.学家预言:21世纪是钛的世纪.工业上利用上述I中副产物Cl
2和钛白粉(TiO
2)生产海绵钛(Ti)的一种工艺流程如下:

已知:①Mg(s)+Cl
2(g)═MgCl
2(s)△H=-641kJ•mol
-1②Cl
2(g)+$\frac{1}{2}$Ti(s)═$\frac{1}{2}$TiCl
4(l)△H=-385kJ•mol
-1(4)钛白粉是利用TiO
2+发生水解生成钛酸(H
2TiO
3)沉淀,再煅烧沉淀制得的.TiO
2+发生水解的离子方程式为TiO
2++2H
2O═H
2TiO
3↓+2H
+.
(5)反应Ⅰ在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为2Cl
2+TiO
2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl
4+2CO;反应Ⅱ的热化学方程式为2Mg(s)+TiCl
4(l)═2MgCl
2(s)+Ti(s)△H=-512kJ/mol.




