
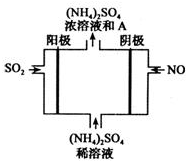
 经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.分析 (1)二氧化硫和氮氧化物是形成酸雨的主要气体;
(2)①已知①4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-900kJ•mol-l
②N2(g)+O2(g)=2NO(g);△H=180kJ•mol-l
氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律计算;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(4)NO得电子生成铵根,发生还原反应;SO2失电子形成硫酸,为氧化反应.
解答 解:(1)二氧化硫和氮氧化物是形成酸雨的主要气体,可与水反应生成亚硫酸、硫酸、硝酸,使雨水酸性较强,故答案为:SO2和NOX;
(2)①已知①4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-900kJ•mol-l
②N2(g)+O2(g)=2NO(g);△H=180kJ•mol-l
依据盖斯定律,将①+②×5得到氨气被一氧化氮氧化生成氮气和气态水的热化学方程式4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1800.0kJ/mol,
故答案为:4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1800.0kJ/mol;
(3)a.反应前后气体的体积不变,则无论是否达到平衡状态,容器内压强都不变化,不能作为判断的依据,故a错误;
b.气体的质量不变,且容器体积不变,无论是否达到平衡状态,混合气体密度都不变化,不能作为判断的依据,故b错误;
c.反应前后,气体的质量和物质的量都不变,则无论是否达到平衡状态,混合气体的平均相对分子质量都不变化,不能作为判断的依据,故c错误;
d.NO的质量分数不再变化,可说明达到平衡状态,故d正确.
故答案为:d;
(4)NO得电子生成铵根,离子方程式为NO+5e-+6H+=NH4++H2O,为阴极反应,阳极上SO2失电子形成硫酸,
故答案为:NO+5e-+6H+=NH4++H2O;硫酸.
点评 本题考查盖斯定律在反应热计算中的应用、电解原理以及环境污染等,题目难度中等,注意掌握盖斯定律的概念,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
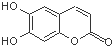 中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )
中草药秦皮中含有的七叶树内酯,具有抗菌作用.若1mol七叶树内酯分别与浓溴水和NaOH溶液完全反应,则消耗的Br2和NaOH的物质的量分别为( )| A. | 2 mol Br2 2 mol NaOH | B. | 2 mol Br2 3 mol NaOH | ||
| C. | 3 mol Br2 4 mol NaOH | D. | 4 mol Br2 4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S+O2═2SO2;△H=-269kJ/mol(反应热) | |
| B. | 2NO2(g)═O2(g)+2NO(g);△H=+116.2kJ/mol(反应热) | |
| C. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 盐酸的物质的量浓度为1 mol•L-1,配制100 mL该溶液可用图3装置进行 | |
| B. | P点时反应恰好完全,溶液呈中性 | |
| C. | 曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,可在图2的装置中进行 | |
| D. | 如果锥形瓶用待测液润洗,会使测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com