
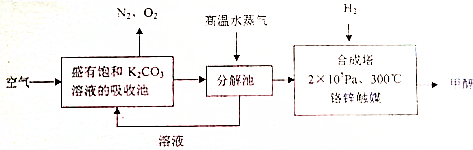
���� ��1��������̼ͨ�뱥��̼�����Һ�����ճ��з�Ӧ����̼����أ�
��2����Ӧ����ʽΪ��CO2��g��+3H2��g��=CH3OH ��g��+H2O��g��������1mol������̼��Ӧ�ų���������������д�Ȼ�ѧ����ʽ��
��3���ںϳ����з������Ƿ��ȷ�Ӧ�����²����ڼ״������ɣ��ϵ���ʱ��Ӧ���ʹ������ϳ�����ά��300��Ľϸ��¶ȣ�������߷�Ӧ���ʣ������ڴ��¶��»������
��Ҫ��״��IJ��ʣ�Ӧ�ı�����ʹƽ��������Ӧ�����ƶ�������ƽ���ƶ�ԭ���������
��4����������������Ӧ���״��ڸ���ʧȥ���ӣ���������������̼���������ˮ��
��5����������ʵ�ƽ��Ũ�ȣ�����ƽ�ⳣ������ʽK=$\frac{c��CO����c��{H}_{2}O��}{c��C{O}_{2}����c��{H}_{2}��}$���㣮
��� �⣺��1��������̼ͨ�뱥��̼�����Һ�����ճ��з�Ӧ����̼����أ���Ӧ�ķ���ʽΪ��K2CO3+CO2+H2O=2KHCO3���ʴ�Ϊ��K2CO3+CO2+H2O=2KHCO3��
��2����Ӧ�ķ���ʽΪCO2��g��+3H2��g��=CH3OH ��g��+H2O��g����n��CO2��=$\frac{440g}{44g/mol}$=10mol����ȫת��Ϊ�״���495 kJ��������������1 mol CH3OH�ų�����49.5 kJ�������������Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g��=CH3OH ��g��+H2O��g����H=-49.5kJ•mol-1 ��2��105Pa��300�棩��
�ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH ��g��+H2O��g����H=-49.5kJ•mol-1 ��2��105Pa��300�棩��
��3���ںϳ����з������Ƿ��ȷ�Ӧ�����²����ڼ״������ɣ��ϵ���ʱ��Ӧ���ʹ���������Ч�ʵͣ��ϳ�����ά��300��Ľϸ��¶ȵ�ԭ����߷�Ӧ���ʣ������ڴ��¶��»������Ӧ�Ƿ��ȷ�Ӧ�����������С�ķ�Ӧ������ƽ���ƶ�ԭ����֪��Ӧ���������״��IJ��ʣ�Ӧ��ȡ���¡���ѹ���״��ӻ����ϵ�з�������Ĵ�ʩ��
�ʴ�Ϊ�����¶��´����Ļ�����ߣ��ϵ���ʱ��Ӧ���ʹ���������Ч�ʵͣ����¡���ѹ�״��ӻ����ϵ�з��������
��4����������������Ӧ���״��ڸ���ʧȥ���ӣ���������������̼���������ˮ�������缫��ӦʽΪ��CH3OH+8OH--6e-=CO32-+6H2O��
�ʴ�Ϊ��CH3OH+8OH--6e-=CO32-+6H2O��
��5��CO2��g��+H2��g��?CO��g��+H2O��g��
��ʼ���ʵ���Ũ�ȣ�mol•L-1����1.0 1.0 0 0
ת�����ʵ���Ũ�ȣ�mol•L-1����0.56 0.56 0.56 0.56
ƽ�����ʵ���Ũ�ȣ�mol•L-1����0.44 0.44 0.56 0.56
ƽ�ⳣ������ʽK=$\frac{c��CO����c��{H}_{2}O��}{c��C{O}_{2}����c��{H}_{2}��}$=$\frac{0.56��0.56}{0.44��0.44}$��1.6��
��986��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ1.6��
���� ����״��ϳ�Ϊ���壬�����Ȼ�ѧ����ʽ��д�����������Ƶķ������ۡ���ѧ��Ӧ�����뻯ѧƽ��Ӱ�����ء��缫��Ӧʽ��д��ƽ�ⳣ������ȣ���������ƴ������Ŀ���Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | �� | �� |
| pH | 12 | 12 |
| ��Һ | ��ˮ | ����������Һ |
| A�� | �٢�����Һ��c��OH-����� | |
| B�� | �٢�����Һ�ֱ��ˮϡ��10����ϡ�ͺ���Һ��pH���٣��� | |
| C�� | ����Һ�����ʵ���Ũ��Ϊ0.01mol•L-1 | |
| D�� | ������Ģ٢�����Һ�ֱ���0.01��mol•L-1��������ȫ�кͣ����������������٣��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X | Y | ||
| W | Z | ||
| T |
| A�� | X��Y��Z��ͼ��⻯��ķе��������� | |
| B�� | X��Y�����γɵĻ�������ֻ�й��ۼ� | |
| C�� | WY2��W3X4��WZ4��Ϊԭ�Ӿ��� | |
| D�� | Ԫ��T�ĵ��ʿ����뵼����ϣ�T��ZԪ�ؿ��γɻ�����TZ4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������Br2�����Ȼ�̼��Һ��ȥ�����е���ϩ | |
| B�� | ��������Һ�м���CuSO4��Һ�������������ټ�ˮ���ܽ� | |
| C�� | ����������Ӧ����ȡ����Ӧ | |
| D�� | ����ˮ�м��뱽������ˮ��Ϊ��ɫ��˵�������巢���ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ij���ʵ�ˮ��ҺPH��7���������һ�������ǿ�������� | |
| B�� | pH=4.5�ķ���֭��c��H+����pH=6.5��ţ����c��H+����100�� | |
| C�� | ϡ�ʹ�����Һ����Һ���������ӵ�Ũ�Ⱦ����� | |
| D�� | pH=5.6��CH3COOH��CH3COONa�����Һ�У�c��Na+����c��CH3COO-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | a����b+c+d��=1��1.5 | B�� | ��a+b������c+d��=1��1 | C�� | a=b=c=d=1.12L | D�� | a+b+c=d=0.2mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ͼ����������s�����ص��γɵģ����γ�s-s�Ҽ� | |
| B�� | s������p�����γ�s-p�Ҽ� | |
| C�� | p���Ӻ�p���Ӳ����γɦҼ� | |
| D�� | HCl�����ﺬ��һ��s-p�Ҽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
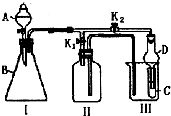 ij��ȤС���������ͼ��ʾ��ʵ��װ�ã��ȿ�������ȡ���壬�ֿ�������֤���ʵ����ʣ�
ij��ȤС���������ͼ��ʾ��ʵ��װ�ã��ȿ�������ȡ���壬�ֿ�������֤���ʵ����ʣ��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com