
【题目】下列物质放置在空气中,不是因发生氧化还原反应而发生变质的是
Na B.Na2O2 C.NaOH D.Fe
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)E、F、G三种元素的原子序数依次增大,其原子的最外层电子排布均为4s1。则F元素在其化合物中最高化合价为 。
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子占有 种能量不同的原子轨道。
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。
如①CH2=CH2 ②CH≡CH③![]() ④
④![]() 等,其中C原子为sp2杂化的分子有 (填序号),预测HCHO分子的立体结构为 形。
等,其中C原子为sp2杂化的分子有 (填序号),预测HCHO分子的立体结构为 形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学选修5:有机化学基础
I.肉桂酸甲酯是调制草莓、葡萄、櫻桃、香子兰等香味的食用香精,在医药工业中作为有机合成的中间体。合成肉桂酸甲酯的工业流程如下图所示:
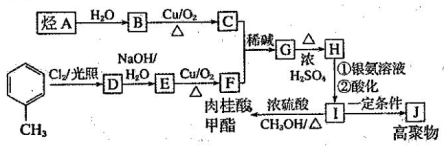
已知:I.醛与醛能发生反应,原理如下:
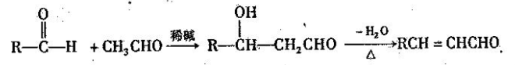
Ⅱ.烃A在标准状况下的密度为1.25 g L-1。
请回答:
(1)化合物E的名称为 。
(2)合成肉桂酸甲酯的工业流程中属于取代反应的有 个,G中所含的官能团有 (写名称)。
(3)G→H的反应化学方程式为 。
(4)写出反应B—C的化学方程式: 。 H→I的反应 (填“能”或“不能”)改用酸性高猛酸钾溶液,简述理由: 。
(5)符合下列条件的I的同分异构伊共有 种。
A.能发生水解酿
B.与银氨溶液作用出现光亮的银镜
C.能与歡生加成反应
Ⅱ.乙炔是有机合成的基础原料。以乙炔为原料制备生物降解塑料PHB的合成路线如下:
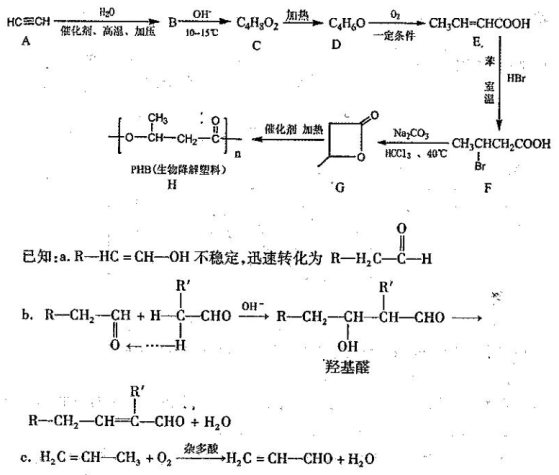
回答下列向题:
(1)B→C为加成反应,则C的名称(系统命名法)为 ; D的结构简式为 。
(2)G→H的反应类型为 ,F中所含官能团的名称为 。
(3)写出D→E的化学方程式 。
(4)C的链状结构同分异构体中,能与氢氧化钠反应,但不能发生银镜反应的有_ 种;其中一种核磁共振氢谱有3组吸收峰,峰的面积的比为1:1:6,其结构简式为: 。
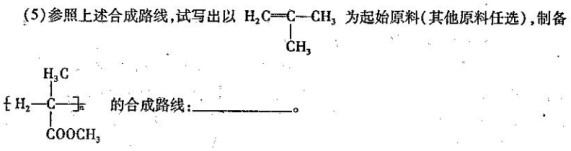
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A.钠和冷水反应 Na+2H2O=Na++2OH+H2↑
B.铁粉投入到硫酸铜溶液中: Fe +Cu2+=Fe2+ +Cu
C.AlCl3溶液中加入足量的氨水: Al3++ 3OH- = Al(OH)3↓
D.澄清石 灰 水 跟 稀 硝 酸 反 应: Ca(OH)2+2H+=Ca2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 _。
(2)常温下一定浓度的MA稀溶液的pH = a,则a 7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH) 2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) = mol· L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯气的叙述中,正确的是( )
A. 氯气是一种黄绿色、有毒的气体
B. 氯气在自然界中既可以以化合态存在,也可以以游离态存在
C. 氯气不能溶解于水,所以可用排水法收集氯气
D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50mo1CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50mo1CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如下表:

(1)开展实验1和实验2的目的是________________。
(2)180℃时,反应到40min,体系_____(填“是”或“否”)达到平衡状态,理由是______________;CH4的平衡转化率为____________。
(3)已知130℃时该反应的化学平衡常数为6.4 ,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率α( NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。

(5)根据已知求算:△H2=_________。
CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) △H2
2N2(g)+CO2(g)+2H2O(g) △H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com