
【题目】常温下,向 100 mL0.01 mol·L-1HA 溶液中逐滴加入0.02 mol .L-1MOH 溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:

(1)由图中信息可知HA为 酸(填“强”或“弱”),理由是 _。
(2)常温下一定浓度的MA稀溶液的pH = a,则a 7(填“ > ”、“,< ”或“=”),用离子方程式表示其原因: ____________,此时,溶液中由水电离出的c(OH-)= 。
(3)请写出K点所对应的溶液中离子浓度的大小关系:_________。
(4)K 点对应的溶液中,c(M+) +c(MOH) 2c (A-)(填“>”“<”或“=”);若此时溶液的 pH = 10,则 c(MOH) +c(OH-) = mol· L-1。
【答案】(1)强、0.01 mol HA溶液中c(H+)=0.01 mol·L-1;
(2)<、M++H2O![]() MOH+H+、1×10-a mol·L-1;
MOH+H+、1×10-a mol·L-1;
(3)c(M+)>c(A-)>c(OH-)>c(H+);(4)=、0.005。
【解析】
试题分析:(1)假设HA为强酸,其c(H+)=0.01mol·L-1,根据pH的公式,pH=2,因此假设成立,HA为强酸;(2)假设MOH为强碱,两者恰好完全反应,消耗MOH的体积为100×10-3×0.01/0.02L=0.05L=50mL,根据图像加入51mLMOH达到pH=7,说明MOH属于弱碱,即MA的属于强酸弱碱盐,pH<7,M++H2O![]() MOH+H+、pH=a,推出c(H+)=10-amol·L-1,水电离出的c(OH-)=c(H+)=10-amol·L-1;(3)K点溶质为MOH、MA,M+水解程度微弱,因此c(M+)>c(A-),此溶液显碱性,c(OH-)>c(H+),根据图像数据,n(MA)>n(MOH),因此是c(M+)>c(A-)>c(OH-)>c(H+);(4)根据物料守恒,n(M+)+n(MOH)=100×10-3×0.02mol=0.002mol,n(A-)=100×10-3×0.01mol=0.001mol,因此有c(M+)+c(MOH)=2c(A-),根据溶液呈现电中性,c(M+)+c(H+)=c(OH-)+c(A-),根据物料守恒,c(M+)+c(MOH)=0.01mol·L-1,代入电中性的式子,推出c(MOH)+c(OH-)=0.01+c(H+)-c(A-)=0.01+10-10-0.005≈0.005mol·L-1。
MOH+H+、pH=a,推出c(H+)=10-amol·L-1,水电离出的c(OH-)=c(H+)=10-amol·L-1;(3)K点溶质为MOH、MA,M+水解程度微弱,因此c(M+)>c(A-),此溶液显碱性,c(OH-)>c(H+),根据图像数据,n(MA)>n(MOH),因此是c(M+)>c(A-)>c(OH-)>c(H+);(4)根据物料守恒,n(M+)+n(MOH)=100×10-3×0.02mol=0.002mol,n(A-)=100×10-3×0.01mol=0.001mol,因此有c(M+)+c(MOH)=2c(A-),根据溶液呈现电中性,c(M+)+c(H+)=c(OH-)+c(A-),根据物料守恒,c(M+)+c(MOH)=0.01mol·L-1,代入电中性的式子,推出c(MOH)+c(OH-)=0.01+c(H+)-c(A-)=0.01+10-10-0.005≈0.005mol·L-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列变化过程中,原物质内仅有共价键被破坏,同时有离子键形成的是( )
A.盐酸和NaOH溶液反应
B.氯化氢溶于水
C.稀硫酸与BaCl2溶液反应
D.氯化氢与氨气反应生成NH4Cl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并充分搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.Fe3+ B.Mg2+ C.Fe2+ D.Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如下图所示。则下列离子组在对应的溶液中,一定能大量共存的是( )

A. a点对应的溶液中:Na+、OH-、SO![]() 、NO
、NO![]()
B. b点对应的溶液中:Al3+、Fe3+、MnO![]() 、Cl-
、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO![]() 、Cl-
、Cl-
D. d点对应的溶液中:F-、NO![]() 、Fe3+、Ag+
、Fe3+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石墨为电极,用A1C14-、A12C17-和有机阳离子组成电解质溶液,其放电工作原理如下图所示。下列说法不正确的是( )
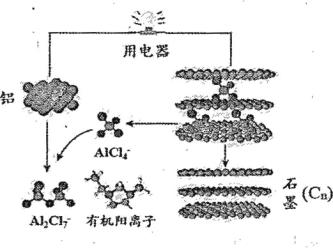
A.放电时,铝为负极、石墨为正极
B.充电时的阳极反应为:Cn+ A1C14- - e-= Cn A1C14
C.放电时的负极反应为:Al-3e- +7 A1C14-=4A12C17-
D.放电时,有机阳离子向铝电极方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com