
【题目】抗击新冠的疫情中,法匹拉韦和瑞德西韦率先突出重围。研究表明两者是新冠肺炎潜在的有效药物,目前正在中国进行 3 期临床实验,下列关于法匹拉韦和瑞德西韦的描述不正确的是
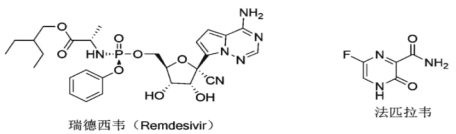
A.瑞德西韦含有酯基,可以水解;法匹拉韦不含酯基,不能水解
B.法匹拉韦分子式为C5H4O2N3F
C.瑞德西韦属于芳香族化合物
D.1mol 瑞德西韦与足量金属钠反应最多生成 1molH2
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】将3. 84 g铜粉与一定质量浓硝酸反应,当铜完全作用时,溶液中的NO3-减少0.1mol,则所消耗硝酸的物质的量是
A.0.1 molB.0.11 molC.0.16 molD.0.22 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“心得安”是质料心脏病的药物,下面是它的一种合成路线(具体反应条件和部分试剂略):
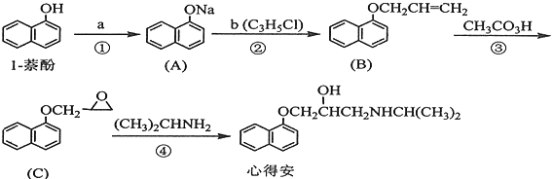
回答下列问题:
(1)试剂a是____________,试剂b的结构简式为______________,b中官能团的名称是_______________。
(2)③的反应类型是____________________。
(3)心得安的分子式为_______________-。
(4)试剂b可由丙烷经三步反应合成:
![]()
反应1的试剂与条件为_______________,反应2的化学方程式为_______________,反应3的反应类型是_______________。(其他合理答案也可)
(5)芳香化合物D是1-萘(酚)的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E(C2H4O2)和芳香化合物F(C8H6O4), E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。D的结构简式为_______________ ;由F生成一硝化产物的化学方程式为_______________,该产物的名称是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的NOx、SO2等,是形成雾霾的主要物质,其综合治理是当前重要的研究课题。
(1)已知:①CO燃烧热的△H1=-283.0kJ·mol-l,②N2(g)+O2(g) ![]() 2NO(g) △H2=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g)
2NO(g) △H2=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g); △H=___。
N2(g)+2CO2(g); △H=___。
(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生上述反应,反应过程中部分物质的浓度变化如下图所示.
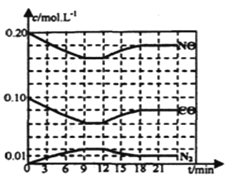
①该反应第一次达到平衡时的平衡常数为________。
②第12min时改变的条件是________。
③在第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将________移动(填“正向”、“逆向”或“不”).
(3)SNCR-SCR脱硝技术是一种新型的除去烟气中氮氧化物的脱硝技术,一般采用氨气或尿素。
①SNCR脱硝技术中:在催化剂作用下用NH3作还原剂还原NO,其主要反应为:4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g),△H<0。体系温度直接影响SNCR技术的脱硝效率,如图所示。当体系温度约为925℃时,SNCR脱硝效率最高,其可能的原因是________。
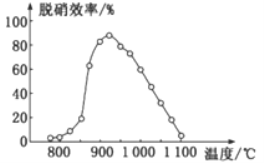
②SCR脱硝技术中则用尿素[CO(NH2)2]作还原剂还原NO2的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。回答下列相关问题:
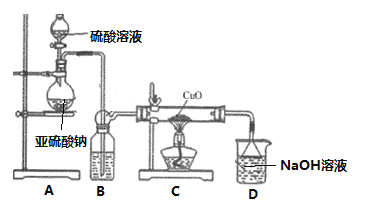
Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式_______________________________________。
(2)在制取SO2时,使用H2SO4溶液的浓度为__________时(填序号,从下列浓度中选取),制备SO2的速率明显快。请解释不选下列其它浓度硫酸的原因____________________。
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式___________________________。
②取红色沉淀物滴加盐酸,反应的离子方程式______________________________________。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为____________。
②CuI沉淀物对I3—具有强的吸附能力,由此会造成CuSO4质量分数测定值_______(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:则CH4的燃烧热为( )
![]() CH4(g)+O2(g)=
CH4(g)+O2(g)= ![]() CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CO2(g)+H2O(l) ΔH=-445.15 kJ·mol-1
CH4(g)+![]() O2(g)=CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
O2(g)=CO(g)+2H2O(l) ΔH=-607.3 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1
A.445.15 kJ·mol-1B.890.3 kJ·mol-1
C.607.3 kJ·mol-1D.802.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应式如下,以下说法不正确的是( )
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
A.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
B.放电时正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C.放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2
D.充电时阳极附近的溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。
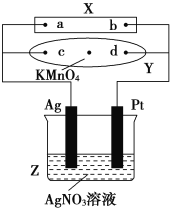
(1)电源正极为_______(填a或者b),滤纸上c点附近会变________色。
(2)电解一段时间后,产生280 mL的气体(标准状况下),此时溶液的体积为500 mL,假设溶液中还有AgNO3存在,则Z中溶液需加入________g的________可使溶液复原。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2,FeCl3的升华温度为315℃。
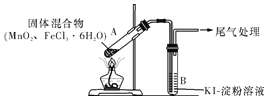
实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾是___。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热FeCl3·6H2O,产生白雾和黄色气体。
b.用KSCN溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有___。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是___。经实验证实推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过进一步实验确认了这种可能性,其实验方案是___。
(4)为进一步确认黄色气体是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中KI淀粉溶液替换为NaBr溶液;检验Fe2+。
现象如下:
方案1 | B中溶液变为蓝色 |
方案2 | B中溶液呈浅橙红色,未检出Fe2+ |
①方案1的C中盛放的试剂是___(填字母)。
A.NaCl饱和溶液 B.NaOH溶液 C.NaClO溶液
②方案2中检验Fe2+的原因是___。
③综合方案1、2的现象,说明选择NaBr溶液的依据是___。
(5)将A中的产物分离得到Fe2O3和MnCl2,A中产生Cl2的化学方程式是:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com