
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。回答下列相关问题:
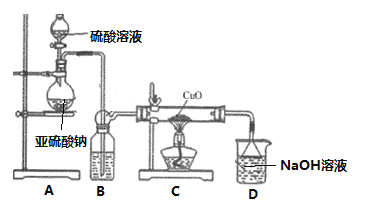
Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式_______________________________________。
(2)在制取SO2时,使用H2SO4溶液的浓度为__________时(填序号,从下列浓度中选取),制备SO2的速率明显快。请解释不选下列其它浓度硫酸的原因____________________。
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式___________________________。
②取红色沉淀物滴加盐酸,反应的离子方程式______________________________________。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为____________。
②CuI沉淀物对I3—具有强的吸附能力,由此会造成CuSO4质量分数测定值_______(填“偏大”或“偏小”)。
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O b 98%的H2SO4溶液c(H+)较小,反应速率较小,5%的H2SO4溶液中水多,SO2易溶解在溶液中不易收集 3CuO+SO2![]() CuSO4+Cu2O Cu2O+2H+=Cu2++Cu+H2O
CuSO4+Cu2O Cu2O+2H+=Cu2++Cu+H2O ![]() 偏小
偏小
【解析】
A中硫酸与亚硫酸钠溶液反应生成二氧化硫,B中为浓硫酸,可用于干燥二氧化硫,在C中加热条件下,黑色固体变为红色,取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈蓝色并仍有少量红色不溶物,说明生成硫酸铜和氧化亚铜,D用于吸收尾气。
(1)装置A制备二氧化硫气体,亚硫酸钠与硫酸反应生成二氧化硫和硫酸钠,发生反应的化学方程式Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)在制取SO2时,使用H2SO4溶液的浓度为65% H2SO4 时,制备SO2的速率明显快,故选b。不选a. 98% H2SO4和C.5% H2SO4,是因为:98%的H2SO4溶液c(H+)较小,反应速率较小,5%的H2SO4溶液中水多,SO2易溶解在溶液中不易收集;
(3)①结合信息Cu2O+2H+=Cu+Cu2++H2O,显示SO2与CuO反应的产物中有Cu2O,SO2被CuO氧化为硫酸根,该化学方程式3CuO+SO2![]() CuSO4+Cu2O;
CuSO4+Cu2O;
②取红色沉淀物滴加盐酸,发生歧化反应生成铜盐和单质铜,反应的离子方程式Cu2O+2H+=Cu2++Cu+H2O;
(4)根据2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-,可以得出关系式2Cu2+~I2~2Na2S2O3,①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为
I3-,I2+2S2O32-=S4O62-+2I-,可以得出关系式2Cu2+~I2~2Na2S2O3,①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为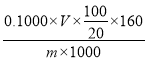 ×100%,则产物中CuSO4质量分数为
×100%,则产物中CuSO4质量分数为![]() ;
;
②因为CuI沉淀物对I3-离子具有强的吸附能力,会造成I2实际消耗量偏少,由此造成CuSO4质量分数测定值偏小。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】A,B,C,D,E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1:2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基).下列叙述错误的是( )
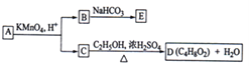
A.B的结构简式为HOOCCH2COOHB.C与乙醇发生了酯化反应
C.A可以与氢氧化钠溶液发生中和反应D.E的分子式为C3H2O4Na2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的恒容容器中,充入1 mol A和3 mol B,并在一定条件下发生如下反应:A(s)+3B(g)![]() 2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
①用B表示的反应速率为0.4 mol·L-1·s-1
②3 s时生成C的物质的量为1.2 mol
③3 s时B的浓度为0.6 mol·L-1
A. ①②B. ①③
C. ②③D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g); △H=-197kJ·mol-l。 实验测得起始、平衡时的有关数据如下表:
2SO3(g); △H=-197kJ·mol-l。 实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2=78.8kJ |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是( )
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=1/5t mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗击新冠的疫情中,法匹拉韦和瑞德西韦率先突出重围。研究表明两者是新冠肺炎潜在的有效药物,目前正在中国进行 3 期临床实验,下列关于法匹拉韦和瑞德西韦的描述不正确的是
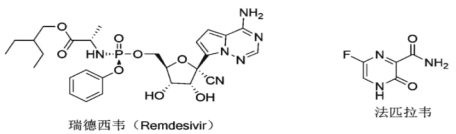
A.瑞德西韦含有酯基,可以水解;法匹拉韦不含酯基,不能水解
B.法匹拉韦分子式为C5H4O2N3F
C.瑞德西韦属于芳香族化合物
D.1mol 瑞德西韦与足量金属钠反应最多生成 1molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是( )
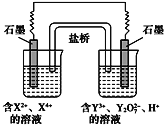
A.左池中阴离子数目增加
B.每消耗1 mol Y2O72-,转移3 mol电子
C.改变右池溶液的c(H+),电流强度不变
D.左池电极反应式:X4++2e-=X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关碳酸钠、碳酸氢钠的说法正确的是

A.25℃时,碳酸氢钠在水中的溶解度比碳酸钠大
B.可用澄清石灰水鉴别碳酸钠溶液和碳酸氢钠溶液
C.可用如图所示装置比较Na2CO3和 NaHCO3的热稳定性
D.常温下,浓度均为0.1mol·L![]() 时的pH:NaHCO3 > Na2CO3
时的pH:NaHCO3 > Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物分子结构简式如图所示,下列关于该物质的说法不正确的是( )
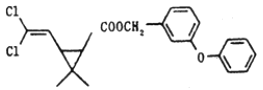
A.分子式为C21H20O3Cl2B.醚键上的氧原子至少与另外11个原子共面
C.该有机物最多与6molH2加成D.在一定条件下可发生加成、取代、氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com