
【题目】如图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是( )
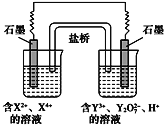
A.左池中阴离子数目增加
B.每消耗1 mol Y2O72-,转移3 mol电子
C.改变右池溶液的c(H+),电流强度不变
D.左池电极反应式:X4++2e-=X2+
科目:高中化学 来源: 题型:
【题目】飞秒(1fs=10-15s)化学广泛应用于化学研究。大多双分子反应难于确定反应历程,Zewail通过研究HI与CO2反应巧妙的解决了这个问题,其反应过程中的片断:![]() (1ps=1000fs)。下列说法不正确的是
(1ps=1000fs)。下列说法不正确的是
A.反应过程中CO2未全部断键而HI全部断键
B.HOCO是HI与CO2双分子反应的过渡态产物
C.观察到HOCO解离需用1ps,说明HI与CO2反应极快
D.该反应的起点是HI的解离,终点是OH自由基与I自由基的结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置探究SO2还原CuO,并进一步检测产物含量。回答下列相关问题:
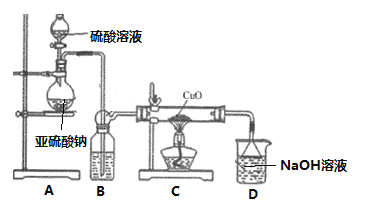
Ⅰ. SO2还原CuO探究
(1)装置A中发生反应的化学方程式_______________________________________。
(2)在制取SO2时,使用H2SO4溶液的浓度为__________时(填序号,从下列浓度中选取),制备SO2的速率明显快。请解释不选下列其它浓度硫酸的原因____________________。
a. 98% H2SO4 b.65% H2SO4 c. 5% H2SO4
(3)充分反应后,黑色固体变为红色。取C中适量的产物,加水后溶液显蓝色并有红色沉淀物,取红色沉淀物滴加盐酸,溶液又呈现蓝色并仍有少量红色不溶物,由此可以得出:
①已知SO2与CuO反应生成两种产物,写出该化学方程式___________________________。
②取红色沉淀物滴加盐酸,反应的离子方程式______________________________________。
Ⅱ.生成物中CuSO4含量检测
(4)用“碘量法”测定产物中CuSO4含量。取m g固体溶解于水配制成100mL溶液,取20.00mL溶液滴加几滴稀硫酸,再加入过量KI溶液,以淀粉为指示剂用Na2S2O3标准溶液滴定,相关化学反应为2Cu2++4I-=2CuI↓+I2,I2+I-![]() I3-,I2+2S2O32-=S4O62-+2I-。
I3-,I2+2S2O32-=S4O62-+2I-。
①若消耗0.1000mol/L Na2S2O3标准溶液VmL,则产物中CuSO4质量分数为____________。
②CuI沉淀物对I3—具有强的吸附能力,由此会造成CuSO4质量分数测定值_______(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,l mol C6H12中含碳碳键的数目一定小于6NA
B.18g果糖分子中含羟基数目为0.6NA
C.4.0g由H218O与D216O组成的混合物中所含中子数为2NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型可充电电池,能长时间保持稳定的放电电压。该电池的总反应式如下,以下说法不正确的是( )
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
A.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
B.放电时正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C.放电时负极反应式为Zn-2e-+2OH-=Zn(OH)2
D.充电时阳极附近的溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
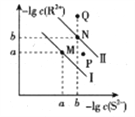
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图进行电解实验(A、B、C、D均为惰性电极),可供选择的电解质溶液列于下表中。要求满足的条件是:
①工作一段时间后甲中溶液的pH上升,乙中溶液的pH下降;
②B、C两极上放电的离子的物质的量相等。
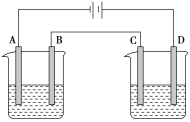
甲 乙
组别 | ① | ② | ③ | ④ |
甲烧杯 | NaOH溶液 | NaCl溶液 | H2SO4溶液 | AgNO3溶液 |
乙烧杯 | CuSO4溶液 | AgNO3溶液 | AgNO3溶液 | CuCl2溶液 |
(1)应选择的电解质溶液是________组。
(2)电极反应式:B极______________________;D极___________________________。
(3)当B极上析出3.55g电解产物时,C极将析出______(填物质名称)的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):
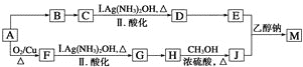
已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;
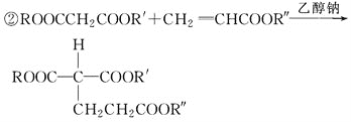
(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com