
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,l mol C6H12中含碳碳键的数目一定小于6NA
B.18g果糖分子中含羟基数目为0.6NA
C.4.0g由H218O与D216O组成的混合物中所含中子数为2NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
【答案】C
【解析】
A. C6H12可能为己烯或环己烷,1mol己烯含有4molCC键和1molC=C键,共5mol碳碳键,但环己烷含6molCC键,则l mol C6H12中含碳碳键的数目不一定小于6NA,A项错误;
B. 果糖的摩尔质量为180g/mol,则18g果糖为0.1mol,一分子果糖含有5个羟基,则18g果糖含有羟基数目为0.5 NA,B项错误;
C. H218O的摩尔质量为20g/mol,分子中含中子数=188=10,D216O的摩尔质量为20g/mol,分子中含中子数=1×2+168=10,则4.0g由H218O与D216O组成的混合物的物质的量为![]() ,则所含中子数为0.2mol×10 NA=2 NA,C项正确;
,则所含中子数为0.2mol×10 NA=2 NA,C项正确;
D. 50g质量分数为46%的乙醇溶液中,乙醇的物质的量为![]() ,乙醇与钠反应生成氢气满足以下关系式:2C2H5OH~H2,则由乙醇与钠反应生成氢气物质的量为0.25mol,而水也能与钠反应生成氢气,则50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目大于0.25NA,D项错误;
,乙醇与钠反应生成氢气满足以下关系式:2C2H5OH~H2,则由乙醇与钠反应生成氢气物质的量为0.25mol,而水也能与钠反应生成氢气,则50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目大于0.25NA,D项错误;
答案选C。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海草(如海带)、海水和盐矿中。某小组同学设计如下实验流程模拟从海草中提取碘。
![]()
(1)灼烧海草时,除需要三脚架外,还需要用到的下列仪器有_____(填标号字母)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥管
(2)“氧化” 是关键步骤。小组同学设计实验探究 KI 溶液的氧化反应,实验记录如表所示:
序号 | 实验 | 操作 | 现象 |
Ⅰ |
| 先加 0.5 mL 0.5 mol/L NaClO 溶液,后滴几滴淀粉溶液 | 溶液先变为浅黄色后溶液变蓝 |
Ⅱ |
| 先加 0.5 mL 0.5 mol/L KI 溶液后滴几滴淀粉溶液 | 先溶液保持无色后溶液也不变蓝,且 pH=10 |
①实验Ⅰ中溶液变为浅黄色所发生反应的离子方程式是:_________________ 。
②对比实验 I 和 II,探究实验 II 反应后“溶液不变蓝”的原因,小组同学提出两种假设:
假设 1:NaClO 溶液显碱性,I2 在碱性溶液发生歧化反应 3I2 +6OH-= IO3-+ 5I-+ 3H2O。
假设 2:NaClO 溶液有强氧化性,可氧化 I2。
(a)NaClO 溶液显碱性的原因: __________(用离子方程式表示)。
(b)设计实验 III,证实假设 2 成立,所用装置如图所示,甲溶液是___________ ,实验现象是______________。
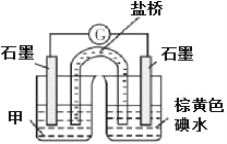
③小组同学又设计了如下实验:
序号 | 实验 | 操作 | 现象 |
Ⅳ |
| 敞口试管 | 2 小时后滴加淀粉溶液才出现蓝色 |
Ⅴ | 敞口试管 水浴 70℃ | 20 min 溶液保持无色,冷却至室温后滴加淀粉溶液出现蓝色 | |
Ⅵ | 密闭试管 水浴 70℃ | 溶液迅速出现黄色,且黄色逐渐加,冷却至室温后滴加淀粉溶液出现蓝色 |
(a)分析实验Ⅳ、Ⅴ和Ⅵ,得出影响氧气氧化 KI 溶液的反应速率的因素有 ____、_____ 。
(b)试解释与实验Ⅵ相比,实验Ⅴ速率较慢的原因 _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟对新型冠状病症状的改善有一定作用,其成分中含有“金银花”。中药“金银花”抗菌杀毒有效成分是“绿原酸”。以下是科研小组设计的“绿原酸”的合成路线:

回答下列问题:
(1)有机物A的名称是__________。
(2)反应①的反应类型是__________。
(3)若碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。写出有机物B的结构简式,用星号(*)标出B中的手性碳__________。
(4)反应D→E中第(1)步的反应方程式是__________。
(5)有机物F中官能团的名称是__________。
(6)反应②的目的是__________。
(7)有机物C的同分异构体有多种,满足以下条件的还有______种。(不考虑立体异构)
a. 具有六元碳环结构;
b. 含有3个氯原子,且同一碳原子上只能连接一个氯原子;
c. 能与NaHCO3溶液反应产生无色无味气泡。
(8)参照上述合成方法,设计由丙酸为原料制备高吸水性树脂聚丙烯酸钠的合成路线如图。
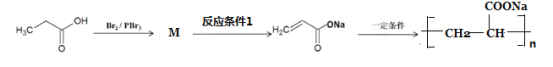
写出M结构简式__________;反应条件1为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是( )
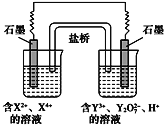
A.左池中阴离子数目增加
B.每消耗1 mol Y2O72-,转移3 mol电子
C.改变右池溶液的c(H+),电流强度不变
D.左池电极反应式:X4++2e-=X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是( )
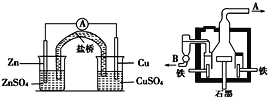
图甲 图乙
A.乙装置中B是氯气出口,A是钠出口
B.乙装置中铁极的电极反应式为:2Na-2e-=2Na+
C.甲装置中锌为负极发生还原反应,铜为正极,发生氧化反应
D.甲装置盐桥可以使反应过程中溶液保持电中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及化合物与我们的生产、生活紧密相关。
(1)Fe3+的基态核外价电子排布式为_____,应用原子结构比较 Fe 与同周期的 Mn 第三电离能(I3)的大小:I3(Mn)______I3(Fe)(填>、<、=)。理由是______。
(2)Fe、Fe2+、Fe3+可以与 CO、SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①配合物 Fe(CO)5 的熔点-20℃,沸点 103℃,可用于制备纯铁。Fe(CO)5 的结构如图所示。下列关于 Fe(CO)5 说法不正确的是____。
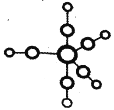
A.Fe(CO)5 是分子晶体
B.Fe(CO)5 中 Fe 原子的配体与C22-互为等电子体
C.Fe(CO)5 中 σ 键与 π 键之比为 1:1
D.Fe(CO)5=Fe+5CO 反应中没有新化学键生成
②CN-的电子式为_____。
③H2NCONH2(尿素)中 N、C 原子的杂化方式分别为_____、______,组成尿素的 4 种元素的第一电离能由大到小的顺序为_____,1 mol H2NCONH2(尿素) 分子中含有 σ 键的数目为_____。
(3)NaCl 和MgO 都属于离子化合物,NaCl 的熔点为 801.3 ℃,MgO 的熔点高达 2800℃。造成两种晶体熔点差距的主要原因是_____。
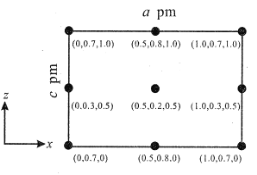
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7 属正交晶系(长方体形)。晶胞参数为 a pm、b pm、c pm。如图为沿 y 轴投影的晶胞中所有 Cs 原子的分布图和原子分数坐标。据此推断该晶胞中Cs 原子的数目为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含![]() 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
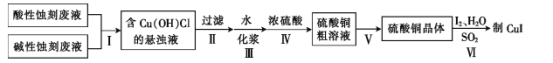
(1)步骤Ⅰ中发生了多个反应,其中![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为____。
与盐酸反应生成Cu(OH)Cl的离子方程式为____。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。
②装置c中反应完成的现象是_____。
③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com