
【题目】如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置。则下列说法正确的是( )
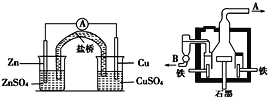
图甲 图乙
A.乙装置中B是氯气出口,A是钠出口
B.乙装置中铁极的电极反应式为:2Na-2e-=2Na+
C.甲装置中锌为负极发生还原反应,铜为正极,发生氧化反应
D.甲装置盐桥可以使反应过程中溶液保持电中性
科目:高中化学 来源: 题型:
【题目】已知Cu2O在酸性条件下易歧化且2Cu2++4I-=2CuI↓+I2;碘单质易溶于碘化钾形成I3—,I3—极易被碘化亚铜吸附。请搭建合适的装置制备二氧化硫并定性与定量的探究其与氧化铜反应的产物。
(一)探究二氧化硫与氧化铜反应
(1)下列仪器按连接顺序排列(填写代表仪器的字母,不考虑夹持和橡皮管连接):A-D-____。
(2)装置B使用消泡膜的目的是____。
(3)充分反应后,硬质玻璃管中黑色固体变红色,取产物少许,加水后部分固体溶解,溶液呈蓝色,过滤红色沉淀物洗涤干净后,加硫酸溶解后溶液也呈蓝色且仍有少量红色难溶物。写出硬质玻璃管中发生的化学方程式____。
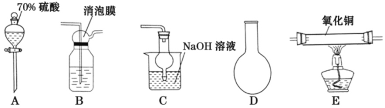
(二)碘量法测定硫酸铜的质量分数。
步骤1:配制并标定Na2S2O3标准溶液,其浓度为a molL—1。
步骤2:取硬质玻璃管产物mg配制为250mL溶液。(Cu2O不溶于水,已过滤掉)
步骤3:取20.00mL溶液,滴加几滴硫酸溶液并加入过量碘化钾溶液,以淀粉溶液作指示剂用硫代硫酸钠标准溶液滴定,消耗体积为VmL,接近终点时加入了硫氰化钾溶液。(I2+2Na2S2O3=Na2S4O6+2NaI)
(4)Na2S2O3溶液需要标定的原因是____,配制该溶液时需要用到的玻璃仪器有试剂瓶、烧杯、____和玻璃棒。
(5)通过上述测定产物中硫酸铜质量分数为____(用含字母的代数式表示),该测定值比实际值____(填“偏小”或“偏大”),原因是____,加入了硫氰化钾溶液的原因可能是____,从而减少实验误差。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在人类文明的历程中,改变世界的事物很多,其中铁、聚乙烯、二氧化硅、苯、青霉素、氨等17种“分子”改变过人类的世界。
(1)铁离子的价层电子排布图为_____________________。
(2)碳化硅晶体、硅晶体、金刚石均是原子晶体,用化学式表示其熔点由高到低的顺序是_________。
(3)1mol 苯分子中含有σ键的数目为_________。
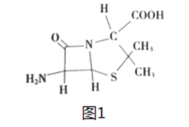
(4)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子电负性由大到小的顺序是____________________。
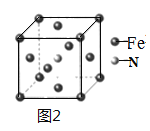
(5)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构如图2所示,写出该产物的化学式______________________________。
(6)晶胞有两个基本要素:
①原子坐标参数:表示晶胞内部各微粒的相对位置。如图是CaF2的晶胞,其中原子坐标参数A处为(-![]() ,-
,-![]() ,0);B处为(0,0,0);则C处微粒的坐标参数为___________。
,0);B处为(0,0,0);则C处微粒的坐标参数为___________。
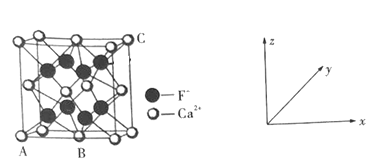
②晶胞参数:描述晶胞的大小和形状。晶胞参数a pm,求CaF2晶体的密度为______g·cm-3,(NA为阿伏加德罗常数的值,用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,l mol C6H12中含碳碳键的数目一定小于6NA
B.18g果糖分子中含羟基数目为0.6NA
C.4.0g由H218O与D216O组成的混合物中所含中子数为2NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一个体重50kg的健康人含Fe元素约2g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc可使食物中的Fe3+转化为Fe2+。人体中经常进行Fe2+![]() Fe3+的转化,在过程A中,Fe2+做__剂,过程B中Fe3+做___剂。
Fe3+的转化,在过程A中,Fe2+做__剂,过程B中Fe3+做___剂。
(2)请按要求正确书写:
①“铁与硫酸铜溶液反应”(离子方程式):__;
②用CO还原Fe2O3(化学方程式):__。
(3)某一反应中有反应物和生成物的粒子共6种:SO32-、I2、H+、SO42-、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
①该反应的还原剂是__(填分子或离子符号)。
②反应过程中,每有1molI2发生反应,转移的电子数为__。
③写出该反应的离子方程式(用单线桥法表示出电子的转移方向及数目)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知: ![]() ≈2.4,
≈2.4, ![]() ≈3.2) ( )
≈3.2) ( )
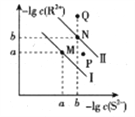
A. M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B. 与P点相对应的NiS的分散系是均一稳定的
C. 向Q点对应的溶液中加水,可转化成N点对应的溶液
D. FeS+Ni2+![]() NiS+Fe2+的平衡常数K=6000
NiS+Fe2+的平衡常数K=6000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某溶液中加入含Fe2+的溶液后,无明显变化,当再滴入几滴过氧化氢溶液后,混合溶液变成红色,则下列结论错误的是
A.该溶液中一定含有SCN![]() B.该变化中Fe2+表现出氧化性
B.该变化中Fe2+表现出氧化性
C.Fe2+与SCN![]() 不能形成红色物质D.Fe2+被过氧化氢氧化为Fe3+
不能形成红色物质D.Fe2+被过氧化氢氧化为Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液中离子存在和转化的表达合理的是( )
A.向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-=A2-+H2O
B.标准状况下,将1.12LCO2气体通入1L0.1mol/L的NaAlO2溶液中:CO2+2H2O+AlO2—=Al(OH)3↓+HCO3-
C.由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3-
D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液使SO42-完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=NH3·H2O+Al(OH)3↓+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
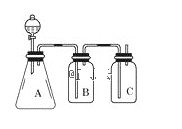
(1)若锥形瓶A中装某可溶性正盐溶液,其化学式为__。
(2)装置B所盛的试剂是__,其作用是__。
(3)装置C所盛试剂溶质的化学式是__。C中反应的离子方程式是__。
(4)由此可得出的结论是:酸性__>__>__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com