
【题目】前四周期元素![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大。
的原子序数依次增大。![]() 与
与![]() 同周期且相邻的非金属元素,
同周期且相邻的非金属元素,![]() 的基态原子的s电子数与p电子数相等,
的基态原子的s电子数与p电子数相等,![]() 是地壳中含量最多的金属元素,
是地壳中含量最多的金属元素,![]() 的原子核外价电子排布式为
的原子核外价电子排布式为![]() ,
,![]() 的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是
的基态原子的未成对电子数是同周期元素中最多的。下列说法错误的是
A.简单气态氢化物的稳定性:![]()
B.简单离子的半径:![]()
C.![]() 的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
的最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.由![]() 、
、![]() 、
、![]() 三种元素形成的某种化合物可用于检查司机是否酒后驾车
三种元素形成的某种化合物可用于检查司机是否酒后驾车
【答案】B
【解析】
五种元素X、Y、Z、W、Q原子序数依次增大,且为前四周期元素。其中Z为地壳中含量最多的金属元素,所以Z为Al。那么X、Y考虑到其同周期且相邻,又都为非金属元素,所以X,Y一定是在第一或第二周期。又因为,Y的基态原子的s电子数与p电子数相等,所以Y的基态原子电子排布式只能为1s22s22p4,那么Y即为O元素,X即为N元素。W的基态原子价电子排布式为4s1,所以W为K元素。根据前面分析,Q只能为第四周期元素,又因为其未成对电子个数是同周期中最多的,所以Q只能为Cr元素。
A.非金属性O>N,所以简单氢化物的稳定性:H2O>NH3,A项正确;
B.X,Y,Z三种元素的简单离子,电子层结构相同,所以原子序数越大的,半径越小,即r(N3-)>r(O2-)>r(Al3+),B项错误;
C.Z的最高价氧化物对应的水化物即Al(OH)3,为两性氢氧化化物,与强酸、强碱均可反应,C项正确;
D.O,K,Cr三种元素可组成化合物K2Cr2O7,可用于检验司机是否酒后驾车,D项正确;
答案选B。


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)锌锰干电池是应用最普遍的电池之一,图1为锌锰干电池的构造示意图,锌锰干电池的负极材料是___(填物质名称),负极发生的电极反应为___。若反应消耗32.5g负极材料,则电池中转移电子的数目为___。
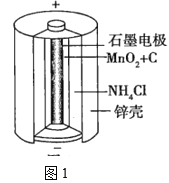
(2)目前常用的镍-镉(Ni—Cd)可充电电池的总反应式可表示为Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___(填序号)。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水,但能溶于酸,以下说法正确的是___(填序号)。
①该电池可以在酸性条件下进行充、放电。
②该电池放电时,负极的电极反应式为Cd+2OH--2e-=Cd(OH)2
③该电池放电时,Cd极的质量减少
④该电池放电时,化学能转变为电能。
(3)图2为氢氧燃料电池的构造示意图,电解质溶液是KOH溶液。则X极为电池的__(填“正”或“负”)极,X极的电极反应式为___。
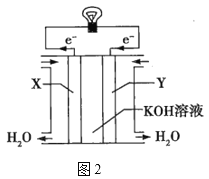
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含H+、![]() 、K+、Al3+、Cu2+、Fe3+、
、K+、Al3+、Cu2+、Fe3+、![]() 、I- 中的一种或几种,取该溶液进行如下实验:
、I- 中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性。
②取部分溶液,加入数滴新制的氯水及少量的CC14,振荡后CC14层显紫色。
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中有白色沉淀生产,后白色沉淀完全消失。
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实回答:
(1) 在溶液中,肯定存在的离子有_______,肯定不存在的离子有______ 。
(2) 不能确定是否存在的离子有______。证明它(们)是否存在的实验方法是______。
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目______ 。
(4)写出步骤④涉及的离子方程式 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的“劣质奶粉”“苏丹红“多宝鱼”等食品安全事件严重威胁消费者的健康和生命安全。劣质奶粉中的蛋白质的含量低于0.37%,被为“空壳奶粉”。下列有关说法正确的是_________(填序号)。
A.蛋白质是重要的营养物质,它有助于食物的消化和排泄
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.在家中可采用灼烧法定性检查奶粉中是否含有蛋白质,蛋白质燃烧可产生特殊的气味
D.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋白质含量的国家标准是:每100g婴幼儿奶粉中含蛋白质12~25g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨,由氨计算出氮,再由氮求出蛋白质的含量(蛋白质的含氮量按16%算)。某市质检局对市场中某个品牌的婴幼儿奶粉进行检验,取100g该奶粉样品进行反应后,生成的NH3和7.5g质量分数为19.6%的稀硫酸能恰好完全反应生成正盐,该品牌的婴幼儿奶粉_________(填“属于”“不属于”)合格奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.洗涤油污常用热的纯碱溶液
C.用加热的方法可以除去KCl溶液中的Fe3+
D.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是

A.R原子不满足8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°两种
C.RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D.分子中5个R—Cl键键能不都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】线型 PAA( ![]() )具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是
)具有高吸水性,网状 PAA 在抗压性、吸水性等方面优于线型 PAA。网状 PAA 的制备方法是:将丙烯酸用 NaOH 中和,加入少量交联剂 a,再引发聚合。其部分结构片段 如图所示,列说法错误的是
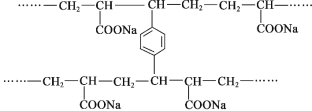
A.线型 PAA 的单体不存在顺反异构现象
B.形成网状结构的过程发生了加聚反应
C.交联剂 a 的结构简式是![]()
D.PAA 的高吸水性与—COONa 有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
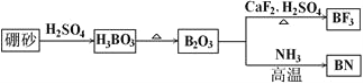
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是________________________、________________________;
(2)基态B原子的电子排布式为________;B和N相比,电负性较大的是________,BN中B元素的化合价为________;
(3)在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4, 的立体构型为________;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为__________,层间作用力为________________________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm。立方氮化硼晶胞中含有________个氮原子、________个硼原子,立方氮化硼的密度是________g·cm-3 (只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于功能高分子材料的说法不正确的是( )
A.生物高分子材料、隐身材料、液晶高分子材料等属于功能高分子材料
B.高分子分离膜可用于海水淡化、分离工业废水、浓缩天然果汁等
C.用于制造![]() 芯片的良好半导体材料单晶硅属于功能高分子材料
芯片的良好半导体材料单晶硅属于功能高分子材料
D.在淀粉、纤维的高分子链上再接上含强亲水性原子团的支链,可提高它们的吸水能力
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com