
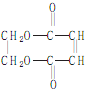
 )的合成路线如下图:
)的合成路线如下图: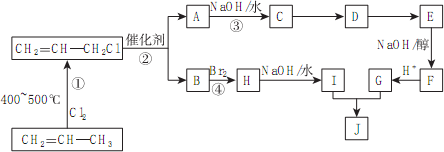
分析 丙烯在加热条件下和氯气发生加成反应生成CH2=CHCH2Cl,CH2=CHCH2Cl在催化剂条件下生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2;B与溴发生加成反应生成H,H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I,I为HOCH2-CH2OH;A在氢氧化钠水溶液、加热条件下发生反应生成C,C为HOCH2CH=CHCH2OH,C生成D是C与HCl的加成反应,故D为HOCH2CH2CHClCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,E发生消去反应生成F,F酸化得到G,故F为NaOOC-CH=CH-COONa,E为HOOCCH2CH(Cl)COOH,据此分析解答.
解答 解:丙烯在加热条件下和氯气发生加成反应生成CH2=CHCH2Cl,CH2=CHCH2Cl在催化剂条件下生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2;B与溴发生加成反应生成H,H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I,I为HOCH2-CH2OH;A在氢氧化钠水溶液、加热条件下发生反应生成C,C为HOCH2CH=CHCH2OH,C生成D是C与HCl的加成反应,故D为HOCH2CH2CHClCH2OH,由J的结构可知,G为HOOC-CH=CH-COOH,E发生消去反应生成F,F酸化得到G,故F为NaOOC-CH=CH-COONa,E为HOOCCH2CH(Cl)COOH,
(1)通过以上分析知,B为CH2=CH2,名称是乙烯,故答案为:乙烯;
(2)反应①、④的反应类型分别是取代反应、加成反应,故答案为:取代反应;加成反应;
(3)卤代烃和NaOH的水溶液发生水解反应生成醇,该反应的反应方程式为ClCH2CH=CHCH2Cl+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaCl,
故答案为:ClCH2CH=CHCH2Cl+2NaOH$→_{△}^{H_{2}O}$HOCH2CH=CHCH2OH+2NaCl;
(4)通过以上分析知,E结构简式为HOOCCH2CH(Cl)COOH,G为HOOC-CH=CH-COOH,官能团名称是羧基和碳碳双键,故答案为:HOOCCH2CH(Cl)COOH;羧基和碳碳双键;
(5)D为HOCH2CH2CHClCH2OH,D的同分异构体中Cl原子位于端头碳原子上,且2个羟基不在同一个碳原子上的有ClCH2CHOHCH2CH2OH、ClCH2CH2CHOHCH2OH、ClCHOHCH2CH2CH2OH、ClCH2CHOHCHOHCH3、ClCHOHCH2CHOHCH3、ClCHOHCHOHCH2CH3、ClCHOHCOH(CH3)2、ClCHOHCH(CH3)CH2OH、ClCH2COH(CH3)CH2OH、ClCH2CH(CH2OH)2,共10种,其中核磁共振氢谱为4组峰,且峰面积比为4:2:2:1的为 ClCH2CH(CH2OH)2,
故答案为:10;ClCH2CH(CH2OH).
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力及信息获取利用能力,根据某些物质结构简式、反应条件、题给信息结合有机物官能团及其性质进行推断,难点是(5)题同分异构体种类判断,注意知识迁移的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)-c(OH-)=c(HCO3-)+2c(CO32-) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | 25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则 c(Na+)-c(CH3COO-)=9.9×10-7mol/L | |
| D. | 25℃时,0.1mol/L的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
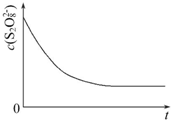 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | FeCl3 | C. | FeCl2 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与液溴在FeBr3的催化作用下,发生取代反应 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 实现化石燃料清洁利用,就无需开发新能源 | |
| D. | 葡萄糖、蔗糖、淀粉在催化剂作用下,均可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 实验药品 | 实验器材(省略加持装置) | |
| A | 制备氧气 | 双氧水、二氧化锰 | 分液漏斗、烧瓶、酒精灯、导管 |
| B | 除去CO2中的HCl气体 | 饱和Na2CO3溶液 | 洗气瓶、导管 |
| C | 配制0.5mol/L、230mL的稀硫酸溶液 | 用98%、1.84g/mL的浓硫酸6.8ml | 10mL量筒、烧杯、玻璃棒、胶头滴管、250容量瓶 |
| D | 检验碳与浓硫酸加热产生的气体中是否含有CO2 | 澄清石灰水 | 烧杯、导管 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.
原子序数依次增大的前四周期元素 A、B、C、D、E中,A 和 C 的最外层电子数相同,B 的电负性是所有元素中最大的元素,C 的电子层数等于最外层电子数,D 的最外层电子数在本周期中除稀有气体外最多的原子,E 元素核外电子排布为[Ar]3d104s1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 1 L 0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2 g Fe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴离子的还原性:Z>Y | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com