
【题目】常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n).下列叙述中不正确的是( )
A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小
B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大
C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)﹣C(OH﹣)=C(CN﹣)﹣C(Na+)
D.溶液中由水电离出的c(H+),前者是后者的10m﹣n倍
【答案】D
【解析】解:常温下,等物质的量浓度的醋酸和氢氰酸,氢氰酸的pH大于醋酸,说明醋酸的酸性大于氢氰酸,A.等pH的两种酸稀释相同的倍数,弱酸的pH变化小于强酸,所以pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化较大,故A错误;
B.醋酸的酸性强于氢氰酸,所以醋酸钠的水解程度小于NaCN,等浓度的CH3COONa和NaCN溶液pH,后者大,故B正确;
C.根据电荷守恒知,c(H+)+c(Na+)=c(OH﹣)+c(CN﹣),所以得c(H+)﹣c(OH﹣)=c(CN﹣)﹣c(Na+),故C正确;
D.酸溶液中由水电离出的氢离子浓度等于溶液中氢氧根离子浓度,0.1molL﹣1CH3COOH和HCN溶,醋酸溶液中由水电离出的c(H+)= ![]() mol/L=10 m﹣14mol/L,氢氰酸溶液中由水电离出的c(H+)=
mol/L=10 m﹣14mol/L,氢氰酸溶液中由水电离出的c(H+)= ![]() mol/L=10 n﹣14mol/L,所以前者是后者的10m﹣n倍,故D正确;
mol/L=10 n﹣14mol/L,所以前者是后者的10m﹣n倍,故D正确;
故选D.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在春暖花开的季节,广州处处鸟语花香,这里的“花香”体现的化学知识是
A. 分子是不可再分的 B. 分子只有在特定的季节才会运动
C. 分子是不停运动的 D. 分子只有在特定的空间才会运动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Fe2+、Mg2+、Cu2+、NH4+、A13+、OH-、SO42- 中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如下图所示。请填写下列空白:
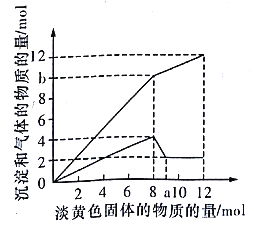
(1)图中a点的值是__________;所加的淡黄色固体是_________ (填化学式)。
(2)该溶液中含有的离子是_________。
(3)如何检验溶液中存在的阴离子? _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列鉴别方法不可行的是( )
A.用水鉴别乙醇、甲苯和硝基苯
B.用燃烧法鉴别甲醇、苯和四氯化碳
C.用酸性高锰酸钾溶液鉴别苯和甲苯
D.用溴水鉴别乙苯、环己烷和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物CH3﹣CH═CH﹣Cl能发生( ) ①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应.
A.以上反应均可发生
B.只有⑥不能发生
C.只有⑦不能发生
D.只有②不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能通过置换反应得到金属铁的是
A. Na与FeSO4溶液常温混合 B. CO通过灼热的Fe2O3
C. H2通入FeSO4溶液 D. Al和Fe3O4混合加热至高温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com