
【题目】已知A~F是中学化学中常见物质,其中A、C、E为气体,且A能使品红溶液褪色;B、D为液体,D的浓溶液在常温下能使铁钝化;F的浓溶液与X共热通常用于实验室制备单质C;X是一种黑色粉末,B分子中有18个电子。(反应中部分生成物已略去)
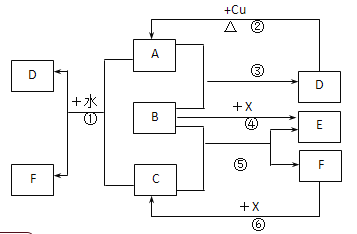
(1)写出反应②的化学方程式:___________________。
(2)写出反应①、⑤的离子方程式:①____________;⑤________________.
(3)根据图中信息,B、C、D、X氧化性从强到弱的顺序是_________________.
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O Cl2+SO2+2H2O=4H++SO42﹣+2Cl﹣ H2O2+Cl2 = O2+2H++2Cl﹣ MnO2>Cl2>H2O2>H2SO4(稀)
CuSO4+SO2↑+2H2O Cl2+SO2+2H2O=4H++SO42﹣+2Cl﹣ H2O2+Cl2 = O2+2H++2Cl﹣ MnO2>Cl2>H2O2>H2SO4(稀)
【解析】
已知A~F是中学化学中常见物质,其中A、C、E为气体,且A能使品红溶液褪色,则A是SO2;B、D为液体,D的浓溶液在常温下能使铁钝化,则D是硫酸;F的浓溶液与X共热通常用于实验室制备单质C;X是一种黑色粉末,判断反应是制备氯气的反应原理,X为MnO2,C为Cl2,F为HCl;B分子中有18个电子,和二氧化硫反应生成硫酸,说明B是氧化剂,推断B为H2O2,在MnO2的催化作用下过氧化氢分解生成氧气和水,E为O2,据此分析解答。
根据以上分析可知A是SO2,B为H2O2,C为Cl2,D是硫酸,E为O2,F为HCl,X为MnO2,则
(1)根据以上分析可知反应②是浓硫酸与金属铜反应,反应的化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)根据以上分析可知反应①是氯气氧化二氧化硫,反应的离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-;反应⑤是氯气氧化双氧水,反应的离子方程式是H2O2+Cl2=O2+2H++2Cl-。
(3)氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则依据反应关系:H2O2+SO2=H2SO4、H2O2+Cl2=O2+2HCl、MnO2+4HCl![]() MnCl2+Cl2↑+2H2O可得到氧化性从强到弱的顺序是:MnO2>Cl2>H2O2>H2SO4(稀)。
MnCl2+Cl2↑+2H2O可得到氧化性从强到弱的顺序是:MnO2>Cl2>H2O2>H2SO4(稀)。


科目:高中化学 来源: 题型:
【题目】下面是常见的电化学装置图,①③④中均为惰性电极,下列说法不正确的是

A. 装置①中正极反应式为:2Cl--2e-=Cl2,负极反应式为:Cu2++2e-=Cu
B. 装置②中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时此时铜片和铁制品的质量差128g
C. 装置③中b极为正极,该极的电极反应方程式为O2+2H2O+4e-=4OH-
D. 装置④阴极的纯水中加入NaOH的作用是:增大离子浓度,增强溶液的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.对同类事物进行再分类可用树状分类法
B.对某物质的分类不可能有多个标准
C.试管、烧杯和容量瓶都可以直接用来加热
D.分液是提纯或分离几种互溶且沸点不同的液体混合物的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ)

(1)实验中能观察到的现象是____________________。(选填代号)
A.试管中镁片逐渐溶解 B.试管中产生无色气泡
C.烧杯外壁变冷 D.烧杯底部析出少量白色固体
(2)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
Ⅱ)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________,除此之外还有一处错误的是____________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值(绝对值)__________(填“偏大、偏小、无影响”)。
Ⅲ)(1)煤燃烧的反应热可通过以下两个途径来利用:a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)===CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)===CO(g)+H2(g)ΔH=E2 ②
H2(g)+1/2O2(g)===H2O(g)ΔH=E3 ③
CO(g)+1/2O2(g)===CO2(g)ΔH=E4 ④
请表达E1、E2、E3、E4之间的关系为E2=_________________。
(2)如图所示在常温常压下,1摩尔NO2 和1摩尔CO完全反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________。

(3)化学反应的焓变与反应物和生成物的键能有关。已知某些化学键的键能如下表所示:
共价键 | H—H | Cl—Cl | H—Cl |
键能/(kJ·mol-1) | 436 | 247 | 434 |
则反应:H2(g)+Cl2(g)=2HCl(g)的焓变ΔH = ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
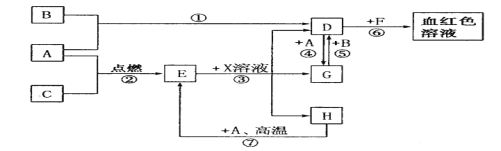
【题目】A、B、C、D为为中学常见单质。通常状况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
请回答下列问题:
(1)写出下列物质的化学式:A______、X______。
(2)在反应;① ~⑦中,属于氧化还原反应的有____个;反应⑥说明D溶液中含有___离子。
(3)反应④的离子方程式是__________。
(4)反应⑦的化学方程式是__________。
(5)检验D的溶液中是否含有G离子的方法是_________。
(6)除去D溶液中混有的少量G的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中常见的几种物质存在如图所示的转化关系.其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C(图中部分产物和反应条件已略去)

回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式__________________________________
(2)固体E中含有化学键的类型是____________,C与E反应的离子方程式为__________________________________
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为_______________________
(4)某课外小组的同学用E溶液吸收C,利用如图2所示装置向吸收液中持续通入SO2气体.
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红.甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学的认为使a变红的是__________________________________(写出一种即可).
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝.用离子方程式解释b变蓝的原因______________________________________________________
③最终试纸b褪色.同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,某同学向 100 mL H2S 饱和溶液中通入SO2, 所得溶液 pH 变化如图所示。下列分析中,正确的是( )

A. ab 段反应是:SO2+ 2 H2S="3S↓+2" H2O
B. 亚硫酸是比氢硫酸更弱的酸
C. 原H2S溶液的物质的量浓度为0.05 molL-1
D. b 点对应的溶液导电性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.高铁酸钾( K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置:
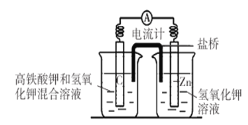
(1)该电池放电时正极的电极反应式为_________________________________________;若维持电流强度为1A,电池工作十分钟,理论消耗Zn_______g(已知F=96500C/mol,小数点后保留1位)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向_______移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向_______移动(填“左”或“右”)。
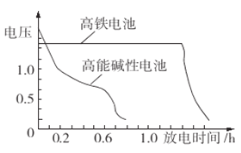
(3)下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有____。
Ⅱ.工业上湿法制备K2FeO4的工艺流程如图。
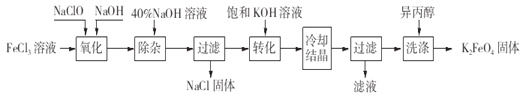
(4)完成“氧化”过程中反应的化学方程式:___FeCl3+___NaOH+___NaClO=___Na2FeO4+___NaCl+___H2O,其中氧化剂是_______(填化学式)。
(5)加入饱和KOH溶液的目的是_____________________。
(6)已知25℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com