
【题目】标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3。下列对这四种气体的关系从小到大表示不正确的是
A. 密度;①<④<③<②
B. 体积 ④<①<②<③
C. 质量 ④<①<③<②
D. 氢原子数 ②<④<③<①
【答案】B
【解析】
试题根据阿伏伽德罗定律的推论:同温同压下,密度之比等于相对分子质量之比,所以密度关系为:①<④<③<②,故A正确;3.01×1023个HCl的体积V=![]() 、
、
13.6gH2S的体积V=![]() 、0.2molNH3的体积V=0.2mol×22.4L/mol═4.48L,所以体积关系为:④<①<③<②,故B不正确;6.72LCH4的质量是m=
、0.2molNH3的体积V=0.2mol×22.4L/mol═4.48L,所以体积关系为:④<①<③<②,故B不正确;6.72LCH4的质量是m=![]() 、3.01×1023个HCl的质量为0.5mol×36.5g/mol=18.25g,0.2molNH3的质量是0.2mol×17g/mol=3.4g,所以质量关系是④<①<③<②,故C正确;6.72LCH4的物质的量为0.3mol,所以氢原子的物质的量为1.2mol,3.01×1023个HCl的物质的量为0.5mol,所以氢原子的物质的量为0.5mol,13.6gH2S的物质的量为0.4mol,所以氢原子的物质的量为0.8mol,0.2molNH3氢原子的物质的量为0.6mol,氢原子数目和氢原子的物质的量成正比,所以氢原子数关系是②<④<③<①,故D正确,答案选B。
、3.01×1023个HCl的质量为0.5mol×36.5g/mol=18.25g,0.2molNH3的质量是0.2mol×17g/mol=3.4g,所以质量关系是④<①<③<②,故C正确;6.72LCH4的物质的量为0.3mol,所以氢原子的物质的量为1.2mol,3.01×1023个HCl的物质的量为0.5mol,所以氢原子的物质的量为0.5mol,13.6gH2S的物质的量为0.4mol,所以氢原子的物质的量为0.8mol,0.2molNH3氢原子的物质的量为0.6mol,氢原子数目和氢原子的物质的量成正比,所以氢原子数关系是②<④<③<①,故D正确,答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)沉淀B的成分是____________(填化学式,下同);
(2)沉淀C的成分是__________;
(3)沉淀F转化为物质M的化学方程式为 _____________________;
(4)溶液D中通入过量CO2生成沉淀F的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质:①氯气,②澄清石灰水,③水银,④稀盐酸,⑤氯化铜固体,⑥熔融氢氧化钠,⑦蔗糖,⑧酒精,⑨二氧化碳,⑩硫酸钡。其中属于电解质的是______(填序号,下面相同),属于非电解质的是_________,能导电的是_________。
(2)写出高锰酸钾受热分解制氧气的化学反应方程式____________________,反应中的氧化剂是________,还原产物是____________,当有2mol电子转移时,生成的氧气在标准状况下的体积是________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树脂交联程度决定了树脂的成膜性。下面是一种成膜性良好的醇酸型树脂的合成路线,如下图所示。

(1)B的分子式为C4H7Br,且B不存在顺反异构,B的结构简式为________,A到B步骤的反应类型是_________。
(2)E中含氧官能团的名称是_________,D的系统命名为_________。
(3)下列说法正确的是_________。
A.1 mol化合物C最多消耗3 mol NaOH
B.1 mol化合物E与足量银氨溶液反应产生2 mol Ag
C.F不会与Cu(OH)2悬浊液反应
D.丁烷、1-丁醇、化合物D中沸点最高的是丁烷
(4)写出D、F在一定条件下生成醇酸型树脂的化学方程式_________。
(5)  的符合下列条件的同分异构体有_______种。
的符合下列条件的同分异构体有_______种。
①苯的二取代衍生物;②遇FeCl3溶液显紫色;③可发生消去反应
(6)①己知丙二酸二乙酯能发生以下反应:

②C2H5OH+HBr→C2H5Br+H2O
利用上述反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇钠为原料合成 ,请你设计出合理的反应流程图__________________。
,请你设计出合理的反应流程图__________________。
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含的原子数一定相等的是
①同质量、不同密度的Cl2和CO ②同温度、同体积的H2和 N2
③同体积、同密度的 C2H4和C3H6两种气体④同压强、同体积的 N2和 CO两种气体.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了如图实验装置探究硝酸的性质,根据图示判断下列结论不正确的是

A. 试管内壁上的“黄霜”的成分是硫
B. 该实验既说明了浓硝酸具有氧化性,又说明了浓硝酸具有挥发性
C. 烧杯内氢氧化钠溶液的作用是除去尾气,防止尾气污染环境
D. 试管中浓硝酸可以用浓盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图所示。下列对t1时刻改变条件的推断正确的是( )
2SO3(g) ΔH<0。达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图所示。下列对t1时刻改变条件的推断正确的是( )
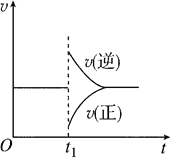
A. 保持压强不变,升高反应温度
B. 保持温度不变,增大容器体积
C. 保持温度和容器体积不变,充入1 mol SO3(g)
D. 保持温度和压强不变,充入1 mol SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下的密闭容器中:NO(g) + CO(g)![]() 1/2N2(g) + CO2(g);△H = -373.2 kJ/mol,达到平衡后,为提高反应速率和NO的转化率,采取的正确措施是 ( )
1/2N2(g) + CO2(g);△H = -373.2 kJ/mol,达到平衡后,为提高反应速率和NO的转化率,采取的正确措施是 ( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com