
 B(g)2C(g)��?��H��QkJ/mol
B(g)2C(g)��?��H��QkJ/mol ʵ�� ʵ����� | | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 8 0 0 �� | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8 0 0 �� | n2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 8 0 0 �� | n3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 7 3 0 �� | 1.0 | 0.90 | 0.80 | 0.75 | 0.70 | 0.65 | 0.65 |
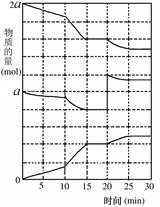
 (g)��3molB(g)����ʱ������ѹǿΪP(ʼ
(g)��3molB(g)����ʱ������ѹǿΪP(ʼ )��
)�� c��ʾ����һ����b��c��ʾ��
c��ʾ����һ����b��c��ʾ��
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ɫ����ˮ���պ���ɫ��dz |
| B��������������Һ�У����������Է�ֹ�������� |
| C����������Ĺ�����ʹ�ù�����������߰����������� |
| D��ʵ���ҳ����ű���ʳ��ˮ�ķ����ռ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ɫ��NO2����ѹ����ɫ�ȱ�����dz |
| B����FeS����Ͷ�뵽����Cu2+�ķ�ˮ���Գ�ȥCu2+ |
| C��ѡ����ʵĴ�����ʹˮ�ڽϵ��¶��·ֽ� |
| D�����з�̪��Na2CO3��Һ�����Ⱥ���ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H2(g)��I2(g)�Ѵﵽƽ�����( )
H2(g)��I2(g)�Ѵﵽƽ�����( )�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g���ﵽƽ��ı�־���� �� ��
2C��g���ﵽƽ��ı�־���� �� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
 2NO2(g)��ѹ��ƽ�ⳣ��Kp�ֱ�Ϊ0.141��0.363��
2NO2(g)��ѹ��ƽ�ⳣ��Kp�ֱ�Ϊ0.141��0.363���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ܹ�������ѧ��Ӧ����ײ����Ч��ײ |
| B������Ӧ���еij̶ȴ�����Ӧ����һ���� |
| C����Ӧ��������������������������ʱ���������ȷ�Ӧ |
| D����ѧƽ�ⷢ���ƶ�ʱ����ѧ��Ӧ����һ���仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g) ��H���D190 kJ��mol��1
2SO3(g) ��H���D190 kJ��mol��1 ����_______________��������ĸ��
����_______________��������ĸ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)+H2O(g),�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���£�
CO(g)+H2O(g),�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���£� | t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com