
分析 有A、B、C、D、五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,所以C是F元素,则B是O元素;D原子最外层有1个单电子,其次外层有3个能级且均排满电子,D为铜元素.
解答 解:有A、B、C、D、五种原子序数依次增大的元素(原子序数均小于30),A的基态原子2p能级有3个单电子,则A是N元素;C的基态原子2p能级有1个单电子,且C的原子序数大于A,所以C是F元素,则B是O元素;D原子最外层有1个单电子,其次外层有3个能级且均排满电子,D为铜元素,
(1)B是O元素,氢化物为水,则冰中每个水分子周围只有4个紧邻的水分子,故1molH2O中含有2mol氢键,氢键数目为2NA,故答案为:2NA;
(2)A、B、C 三种元素为N、O、F,非金属性F>O>N,非金属性越强,氢化物稳定性越强,故答案为:HF>H2O>NH3;
(3)A的最简单氢化物为NH3,NH3分子中氮原子价层电子对=3+1=4,且含有一个孤电子对,所以分子空间构型是三角锥型,采取sp3杂化,
故答案为:三角锥型;sp3;
(4)A为N,氮气的结构式为:N≡N,所以氮气分子中含有一个σ键两个π键,故答案为:1;2;
(5)D为铜,根据构造原理知,其基态原子的电子排布式[Ar]3d104s1;价电子排布式为3d104s1,故答案为:3d104s1.
点评 本题涉及分子空间构型的判断、杂化方式的判断、第一电离能的判断等知识点,这些都是考试热点,注意第一电离能的变化趋势及异常现象,为易错点.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
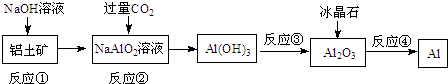
| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
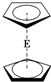 E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为
E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为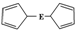 .1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )
.1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )| A. | 5,5 | B. | 3,5 | C. | 5,1 | D. | 3,1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
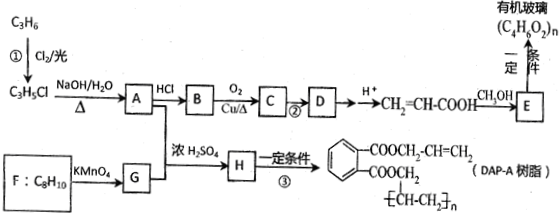
 ;
;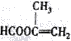 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 | B. | 1.6 mol•L-1 | C. | 0.8 mol•L-1 | D. | 0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | NaHCO3溶液与NaOH溶液反应:OH-+HCO3-═CO2↑+H2O | |
| C. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.
喷泉是一种常见的自然现象,其产生原因通常是装置内外存在压强差.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com