
分析 (1)电解质是在水溶液里或熔融状态下能导电的化合物,包括酸、碱、盐、活泼金属氧化物和水;
(2)非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
(3)能导电的物质中含有自由移动的电子或离子;
(4)纯净物只由一种物质组成,据此即可解答.
解答 解:(1)电解质包括酸、碱、盐、活泼金属氧化物和水,所以①H2SO4、②CaO、③NaOH、④熔融BaSO4是电解质;
故答案为:①②③④;
(2)非电解质包括一些非金属氧化物、氨气、大多数有机物等,所以⑥SO2、⑧C2H5OH是非电解质,故答案为:⑥⑧;
(3)④熔融BaSO4、⑤盐酸、⑦氨水、⑩氯化钠溶液中含有自由移动的离子,所以能导电,⑨Cu含有自由移动的电子,所以能导电;
故答案为:④⑤⑦⑨⑩;
(4)①H2SO4、②CaO、③NaOH、⑥SO2都是纯净物,且水溶液中含有自由移动的离子而导电,故答案为:①②③⑥.
点评 本题考查物质的分类以及物质导电的原因,解答时应对概念十分清晰.抓住概念中的关键词,并注意大多数有机化合物都是非电解质,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应体系的压强,反应速率增大 | |
| B. | 加入碳粉,平衡向右移动,原因是碳与O2反应,降低了生成物的浓度且放出热量 | |
| C. | 电解熔融的Al2O3和AlCl3均能得到单质铝 | |
| D. | 升高温度,反应的平衡常数将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
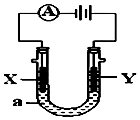 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 在分液漏斗中进行萃取操作时应该边振荡边放气 | |
| C. | 蒸馏操作时,使用的冷凝水应该由低往高流,形成逆流 | |
| D. | 过滤时,用玻璃棒轻轻搅拌以加速过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1+△H2=△H | |
| B. | I-是H2O2分解反应的催化剂 | |
| C. | 欲分解2 mol H2O2(l),至少需要提供98 kJ的热量 | |
| D. | 若生成1 mol O2,则反应ii转移电子的物质的量为2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
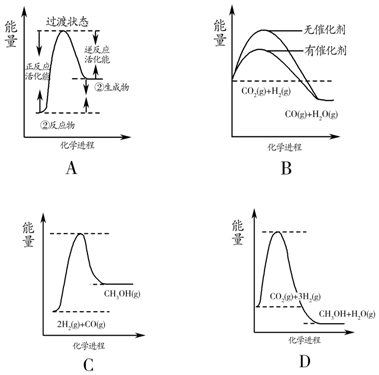
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示:| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸滴在大理石上:CaCO3+2H+=Ca2++H2CO3 | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 氧化铜与稀硫酸反应:2H++O2-═H2O | |
| D. | 碳酸钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com