
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
分析 ①依据化学方程式书写平衡常数,用生成物浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
②依据反应速率概念计算;
③每有1mol N2O5分解,吸收Q kJ的热量,分解2molN2O5分解,吸收2Q kJ的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式.
解答 解:①应为2N2O5(g)?4NO2(g)+O2(g),反应的平衡常数表达式K=$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$,故答案为:$\frac{{c}^{4}(N{O}_{2})•c({O}_{2})}{{c}^{2}({N}_{2}{O}_{5})}$;
②1000s内N2O5的消耗物质的量浓度=5.00mol/L-2.48mol/L=2.53mol/L,分解速率=$\frac{2.53mol/L}{1000s}$=0.00252mol/(L•s),故答案为:0.00252mol/(L•s);
③每有1mol N2O5分解,吸收Q kJ的热量,分解2molN2O5分解,吸收2Q kJ的热量,标注物质聚集状态和对应反应的焓变写出热化学方程式:2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol,
故答案为:2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ/mol.
点评 本题考查化学平衡常数意义及应用等知识,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
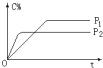 可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )| A. | P1>P2,n>3 | B. | P1>P2,n<3 | C. | P1<P2,n<3 | D. | P1<P2,n>3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用燃煤脱硫技术,防治SO2污染 | |
| B. | 使用天然气热水器取代电热水器 | |
| C. | 推荐使用手帕,尽量减少使用面纸 | |
| D. | 在建筑、布展、运营过程中应用大规模的太阳能光伏发电系统 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
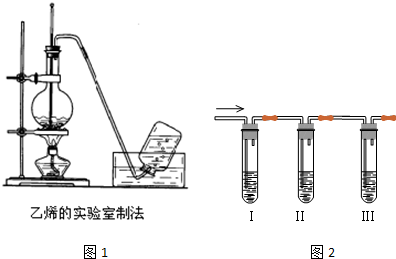
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒重操作是指加热、冷却、称量这一过程重复两次 | |
| B. | 加热时不断用玻璃棒搅拌 | |
| C. | 加热时晶体不小心溅出坩埚,再加一些胆矾 | |
| D. | 为了节约时间,加热时直接用大火加热直至最后 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,0.5 mol任何气体的体积都必定是11.2 L | |
| B. | 在标准状况下,1 mol任何物质的体积都约是22.4 L | |
| C. | 常温常压下,1 mol任何气体的体积都约是22.4 L | |
| D. | 在标准状况下,0.5 mol CO2所占有的体积约是11.2 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com