


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| A、硫酸铜溶液与氢氧化钠溶液反应生成氢氧化铜蓝色沉淀 |
| B、河流入海处易形成沙洲 |
| C、早晨阳光穿过茂密的林木枝叶产生的美丽景象 |
| D、在豆浆里加入盐卤做豆腐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑥ | B、④⑤⑧ |
| C、③⑥⑧ | D、⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| B、7.8gNa2O2与CO2完全反应,转移0.2mol电子 |
| C、能通过化合反应制得FeCl3和Fe(OH)3 |
| D、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
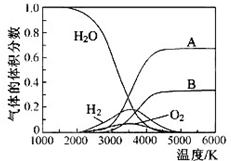 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com