
【题目】铋(Bi)的两种同位素原子分别为: ![]() Bi与
Bi与 ![]() Bi,下列说法中正确的是( )
Bi,下列说法中正确的是( )
A.![]() Bi比
Bi比 ![]() Bi的质量数小1
Bi的质量数小1
B.![]() Bi和
Bi和 ![]() Bi都含有83个中子
Bi都含有83个中子
C.![]() Bi和
Bi和 ![]() Bi的核外电子数不同
Bi的核外电子数不同
D.![]() Bi和
Bi和 ![]() Bi分别含有126和127个质子
Bi分别含有126和127个质子
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】现用质量分数为98%,密度为1.84g/cm3的浓硫酸来配制200ml 1mol/L的稀硫酸,可供选择的仪器有:①量筒 ②烧杯 ③胶头滴管 ④玻璃棒.
(1)除上述仪器中,配制过程中还差的有 .
(2)计算所需浓硫酸的体积为 . 现有①5ml ②10ml ③20ml④50ml四种规格的量筒,最好选用 . (填代号)
(3)在配制过程中,下列操作可引起所配溶液浓度偏低的有 . (填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中.
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
⑤定容量,仰视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl﹣、OH﹣、HCO ![]() 、NO
、NO ![]() .已知该溶液能跟铝粉反应,且放出的气体只有H2 . 试回答:
.已知该溶液能跟铝粉反应,且放出的气体只有H2 . 试回答:
(1)若溶液和铝粉反应后有AlO ![]() 生成,则溶液中一定含有大量的离子,还可能含有大量的离子.
生成,则溶液中一定含有大量的离子,还可能含有大量的离子.
(2)若溶液和铝粉反应后有Al3+生成,则原溶液中一定不含有大量的离子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的一部分如图,请参照元素①~⑨在表中的位置,用化学用语回答下列问题: 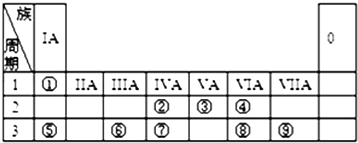
(1)已知②的一种核素中子数为8,则其气态氢化物的摩尔质量为
(2)①②⑤⑥的原子半径由大到小的顺序为(填元素符号);⑦⑧⑨的最高价含氧酸的酸性由强到弱的顺序是(填化学式): .
(3)⑥的最高价氧化物可以与⑤的最高价氧化物对应水化物的溶液能发生反应,该反应的化学方程式为:
(4)X、Y是中学化学中的常见物质,X、Y分别由元素④、⑤和②、④组成,X与Y的反应是潜水艇和呼吸面具中氧气的来源.X的电子式是 , Y中含有的化学键类型是 .
(5)某研究性学习小组设计了一组实验来探究元素周期律.甲同学设计了如图装置来一次性完成的②、⑦非金属性强弱比较的实验研究. 
甲同学设计实验的依据是;其中装置B中所盛试剂的作用为;C中反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式不正确的是( )
A.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+
B.电解熔融氧化铝:2Al2O3(熔融) ![]() 4Al+3O2↑
4Al+3O2↑
C.NaHCO3溶液与稀H2SO4反应:HCO3﹣+H+═H2O+CO2↑
D.向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况.请分析以下一组有现象变化的化学反应.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5molL﹣1NaOH溶液:再滴加1.5mL1.0molL﹣1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
0.1molL﹣1AlCl3溶液 | Ⅱ.加碱时 ;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
0.1molL﹣1Fe(NO3)2溶液 | Ⅲ.加碱时 ;加酸后溶液变为黄色 | ||
新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
(1)用离子方程式解释现象I中出现胶状沉淀的原因: .
(2)II中加碱时出现的现象是 , 此现象说明溶液中发生反应的离子方程式是 .
(3)III中加碱时出现的现象是 .
(4)用离子方程式解释IV中加碱时出现的现象 .
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 molL﹣1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 molL﹣1 H2SO4溶液; | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1molL﹣1Fe(NO3)2溶液中 , 溶液立即变红,说明溶液中含Fe3+ , 证明加酸时溶液中发生了反应.
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1molL﹣1 Fe(NO3)2溶液中的Fe2+被NO3﹣氧化;
b.(用离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2═2AB的能量变化如图所示,则下列说法正确的是( ) 
A.该反应是吸热反应
B.断裂1 mol A﹣A键和1 mol B﹣B键能放出x kJ的能量
C.断裂2 mol A﹣B键需要吸收y kJ的能量
D.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com